
| A. | 乙烯的结构简式:CH2CH2 | B. | 四氯化碳的电子式: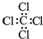 | ||
| C. | 甲烷分子的比例模型: | D. | HClO的结构式:H-Cl-O |
分析 A.结构简式中需要标出官能团结构,乙烯分子中含有碳碳双键;
B.四氯化碳的电子式中漏掉了每个氯原子的3对孤电子对;
C.比例模型主要体现出分子中各原子的相对体积大小,碳原子半径大于氢原子;
D.次氯酸分子中不存在氢氯键,中心原子为O原子.
解答 解:A.乙烯分子中含有碳碳双键,乙烯正确的结构简式为:CH2=CH2,故A错误;
B.四氯化碳分子中含有4个碳氯键,碳原子和氯原子最外层达到8电子稳定结构,四氯化碳正确的电子式为: ,故B错误;
,故B错误;
C.甲烷为正四面体结构,分子中含有4个碳氢键,甲烷的比例模型为: ,故C正确;
,故C正确;
D.次氯酸分子中含有1个氧氢键和1个氧氯键,次氯酸正确的结构式为:H-O-Cl,故D错误;
故选C.
点评 本题考查了常见化学用语的书写方法,题目难度中等,涉及比例模型、电子式、结构式、结构简式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生规范答题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式为:CH3OCH3-12e-+12OH-═2CO2+8H2O | |
| B. | 二甲醚为不可再生能源 | |
| C. | 二甲醚分子中只含有极性键 | |
| D. | 二甲醚燃烧的热化学方程式表示为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-1455kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子中不存在碳碳双键,所以不能发生加成反应 | |
| B. | 乙醇能发生氧化反应,乙酸则不可能发生氧化反应 | |
| C. | 乙酸和乙醇制乙酸乙酯与苯甲酸乙酯水解制苯甲酸和乙醇都属于取代反应 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol硫酸铝钾中阴离子所带电荷总数为2NA | |
| B. | 等质量的乙炔和苯分别完全燃烧,乙炔和苯都消耗7.5NA个氧气分子 | |
| C. | 将0.1mol碳酸钠溶于1L水中,所得溶液含有CO32-和HCO3-共0.1NA个 | |
| D. | 在H2O2作燃料电池的负极原料时,每摩尔H2O2转移的电子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
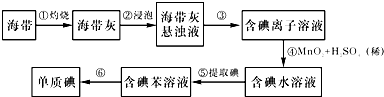
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再滴加AgNO3溶液,观察是否有AgI沉淀产生 | |
| B. | 加入CCl4振荡后,观察下层液体颜色 | |
| C. | 再滴加AgNO3溶液,观察是否有AgCl沉淀产生 | |
| D. | 再滴加KSCN溶液,观察是否有血红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
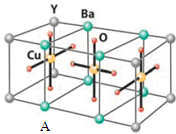

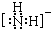 ,其中心原子的杂化类型是sp3杂化
,其中心原子的杂化类型是sp3杂化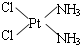 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com