
| A. | 以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式为:CH3OCH3-12e-+12OH-═2CO2+8H2O | |
| B. | 二甲醚为不可再生能源 | |
| C. | 二甲醚分子中只含有极性键 | |
| D. | 二甲醚燃烧的热化学方程式表示为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-1455kJ/mol |
分析 二甲醚分子中含有C-H、C-O等共价键,工业上用合成气(CO、H2)直接或间接制取二甲醚,说明二甲醚可再生,以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,二甲醚应被氧化生成碳酸钾,结合燃烧热的定义解答该题.
解答 解:A.二甲醚生成的二氧化碳会和氢氧根离子反应生成碳酸根离子,所以该电池中负极上的电极反应式为:CH3OCH3-12e-+16OH-=2CO32-+11H2O,故A错误;
B.工业上用合成气(CO、H2)直接或间接制取二甲醚,二甲醚为可再生资源,故B错误;
C.二甲醚分子中,碳原子和氢原子之间存在极性键,碳原子和氧原子之间存在极性键,故C正确;
D.该反应方程式中水蒸气不是稳定氧化物,应改为液态水,故D错误.
故选C.
点评 本题考查了化学键的判断、电极反应式和燃烧热方程式等知识点,难点是书写电极反应式,注意书写电极反应式时要结合电解质溶液的酸碱性判断生成物.


科目:高中化学 来源: 题型:选择题
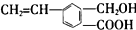 ,关于M的说法正确的是( )
,关于M的说法正确的是( )| A. | M中只有两种官能团 | |
| B. | 1 molM最多能消耗2 mol NaOH | |
| C. | M能使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色 | |
| D. | M可以发生酯化、加成反应,不能发生聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①③⑤⑥⑦ | C. | 只有①⑦ | D. | ③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和乙醇 | B. | 甲醇和乙醛 | C. | 丁烷和乙酸乙酯 | D. | 葡萄糖和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2CH2=CH2+O2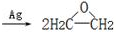 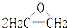 是理想的原子经济,原子利用率为100% 是理想的原子经济,原子利用率为100% | |
| B. | 含磷合成洗涤剂易被细菌分解,故不会导致水体污染 | |
| C. | CO2的大量排放能破坏臭氧层,形成“臭氧空洞” | |
| D. | pH在5.6~7.0之间的降水通常称为酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液.
某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、OH-、Cl- | B. | Na+、NH4+、Cl- | C. | Cu2+、K+、Cl- | D. | K+、SO32-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 物质X、Y、Z有如图转化关系:请回答下列问题:
物质X、Y、Z有如图转化关系:请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com