
| A、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、硫酸溶液中加入Ba(OH)2溶液:SO42-+Ba2+=BaSO4↓ |
| C、用稀硫酸洗去铁锈:Fe2O3+6H+=2Fe3++3H2O |
| D、将铝片插入硝酸铜溶液中:Cu2++Al=Al3++Cu |


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
| A、等体积、浓度均为1 mol/L的硫酸和盐酸中,氢离子数之比为2:1 | ||
B、将wg质量分数为 a%的NaCl溶液蒸发掉
| ||
| C、将1体积c mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c mol/L | ||
| D、将5.85gNaCl晶体溶入1000mL水中,制得的NaCl溶液不为0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | Na+ | Al3+ | Cl- | X |
| 个数 | 3NA | 2NA | NA | m |
| A、NO3-、4NA |
| B、SO42-、4NA |
| C、OH-、4NA |
| D、SO42-、8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.3g金属钠变为Na+时失去的电子数为NA |
| B、18gH2O所含的原子数目为NA |
| C、常温下22.4L氢气所含的原子数目为2NA |
| D、100℃、1.01×105Pa 32gO2所含的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铜与盐酸、氢氧化铜与硫酸 |
| B、氯化钡溶液与硫酸钠溶液、氢氧化钡溶液与稀硫酸 |
| C、碳酸钠溶液与盐酸、碳酸钙与盐酸 |
| D、石灰石与醋酸、石灰石与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
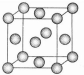 现有原子序数依次增大的A、B、C、D、E、F、G七种前36号元素.已知A、B组成的10个电子4核分子X,能使湿润的红色石蕊试纸变蓝,A、B还能组成18个电子6核分子Y;C原子的最外层电子书是次外层电子书的3倍;D、E、F三原子的最外电子层中共有10个电子,这三种元素的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水;G原子核电子排布中未成对电子数在前36号元素原子钟最多.
现有原子序数依次增大的A、B、C、D、E、F、G七种前36号元素.已知A、B组成的10个电子4核分子X,能使湿润的红色石蕊试纸变蓝,A、B还能组成18个电子6核分子Y;C原子的最外层电子书是次外层电子书的3倍;D、E、F三原子的最外电子层中共有10个电子,这三种元素的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水;G原子核电子排布中未成对电子数在前36号元素原子钟最多.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com