
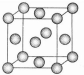
 现有原子序数依次增大的A、B、C、D、E、F、G七种前36号元素.已知A、B组成的10个电子4核分子X,能使湿润的红色石蕊试纸变蓝,A、B还能组成18个电子6核分子Y;C原子的最外层电子书是次外层电子书的3倍;D、E、F三原子的最外电子层中共有10个电子,这三种元素的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水;G原子核电子排布中未成对电子数在前36号元素原子钟最多.
现有原子序数依次增大的A、B、C、D、E、F、G七种前36号元素.已知A、B组成的10个电子4核分子X,能使湿润的红色石蕊试纸变蓝,A、B还能组成18个电子6核分子Y;C原子的最外层电子书是次外层电子书的3倍;D、E、F三原子的最外电子层中共有10个电子,这三种元素的最高价氧化物的水化物之间,两两皆能反应且均生成盐和水;G原子核电子排布中未成对电子数在前36号元素原子钟最多.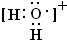 ;该阳离子与F氢化物的水溶液反应生成一种黄色固体,则黄色固体为S,H2O+与H2S发生氧化还原反应生成S、水与H+,其反应的离子方程式为:2H2O++H2O=S↓+2H2O+2H+;
;该阳离子与F氢化物的水溶液反应生成一种黄色固体,则黄色固体为S,H2O+与H2S发生氧化还原反应生成S、水与H+,其反应的离子方程式为:2H2O++H2O=S↓+2H2O+2H+;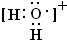 ;2H2O++H2O=S↓+2H2O+2H+.
;2H2O++H2O=S↓+2H2O+2H+.


科目:高中化学 来源: 题型:
| 25 |
| 2 |
| A、H2 |
| B、CO |
| C、C8H18 |
| D、CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、硫酸溶液中加入Ba(OH)2溶液:SO42-+Ba2+=BaSO4↓ |
| C、用稀硫酸洗去铁锈:Fe2O3+6H+=2Fe3++3H2O |
| D、将铝片插入硝酸铜溶液中:Cu2++Al=Al3++Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化合物都是不同元素组成的,不同元素组成的物质一定是化合物 |
| B、有的化学反应不属于化合、分解、置换、复分解反应中的任何一种 |
| C、一种元素可能有多种氧化物,但同种价态只能对应一种氧化物 |
| D、饱和溶液浓度一定比不饱和溶液的浓度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
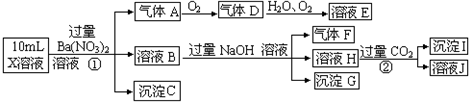
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com