
| A、铋能形成很稳定的气态氢化物 |
| B、铋的最高价氧化物对应的水化物的酸性比磷酸强 |
| C、铋单质可能具有良好的导电性并具有较大的密度 |
| D、铋的两种常见氧化物Bi2O3和Bi2O5,一定是碱性氧化物 |


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、①②④⑤ |
| C、③④⑤ | D、①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A2>B2>C2>D2 |
| B、B2>A2>C2>D2 |
| C、C2>B2>A2>D2 |
| D、D2>C2>B2>A2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2NaHCO3═Na2CO3+H2O+CO2↑ |
| B、KClO3+6HCl(浓)=KCl+3H2O+3Cl2↑ |
| C、CO2+Ca(OH) 2=CaCO3↓+H2O |
| D、FeS+H2SO4=FeSO4+H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | |||
| W | ||||
| A、Z与Q形成的化合物水溶液不一定显酸性 |
| B、气态氢化物稳定性:Y>W |
| C、Y的单质比W的单质沸点高 |
| D、原子半径从大到小排列是:Z>X>Y>W>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18.4mol?L-1 34.7% |
| B、20.4mol?L-1 38.5%q2 |
| C、18.4mol?L-1 38.5% |
| D、20.4mol?L-1 34.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
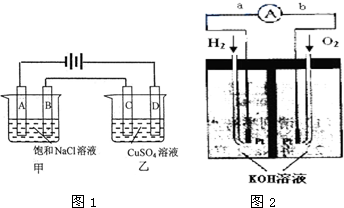 电解原理在化学工业上有着广泛的应用,按图1所示所示装置进行电解实验.A、B、C、D均为惰性电极,开始电解前在甲装置的A、B极两侧各滴入酚酞试液.工作一段时间后:
电解原理在化学工业上有着广泛的应用,按图1所示所示装置进行电解实验.A、B、C、D均为惰性电极,开始电解前在甲装置的A、B极两侧各滴入酚酞试液.工作一段时间后:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com