
【题目】某矿石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用该矿石制备BaCl22H2O的流程如图,且三次滤渣的主要成分各不相同:
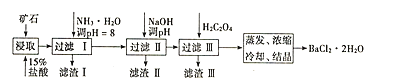
如表为常温时各离子转化为氢氧化物沉淀时的pH:
Fe3+ | Mg2+ | Ca2+ | |
开始沉淀时的pH | 1.9 | 9.1 | 11.9 |
完全沉淀时的pH | 3.2 | 11.1 | 13.9 |
(1)用15%盐酸浸取前需充分研磨,目的是______。
(2)滤渣Ⅰ的主要成分为______;加入NaOH调pH的范围为______;加入H2C2O4时应避免过量的原因是______。[已知难溶物质:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9]
(3)已知:25℃时,Ksp(BaCO3)=5.4×10-9,Ksp(CaCO3)=2.7×10-9。向CaCO3固体的溶液中加入高浓度的BaCl2溶液,有BaCO3沉淀生成,请写出该反应的离子方程式______,该反应的平衡常数K=______。
(4)取制得的BaCl22H2O(含少量杂质)2.5g配成100mL溶液,取10.00mL该溶液于烧杯中,加入足量(NH4)2C2O4溶液,过滤,洗涤,将得到的BaC2O4沉淀用过量稀硫酸溶液溶解,过滤除去BaSO4沉淀,将所得的H2C2O4溶液移入锥形瓶,用0.05mol/L高锰酸钾标准液滴定至终点。
已知:Ba2++C2O42-═BaC2O4↓
BaC2O4+2H++SO42-═BaSO4↓+H2C2O4
5H2C2O4+2MnO4-+16H+═10CO2↑+2Mn2++8H2O
①滴定中盛放高锰酸钾标准液的仪器为______,滴入最后一滴高锰酸钾溶液,锥形瓶中溶液颜色______,即说明达到滴定终点。
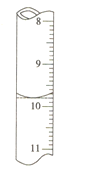
②若滴定前滴定管的读数为1.80mL,滴定终点时滴定管中液面如图,请计算BaCl22H2O的纯度为______(保留3位有效数字)。
【答案】增大接触面积,使反应速率加快 Fe(OH)3 11.1<pH<11.9 H2C2O4过量会导致生成BaC2O4沉淀,BaCl22H2O的产量减少 CaCO3(s)+Ba2+(aq) BaCO3(s)+Ca2+(aq) 0.5 酸式滴定管 由无色变为红色,且半分钟不褪色 97.6%
【解析】
制备BaCl22H2O的流程:矿石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),加盐酸溶解,碳酸钡和盐酸反应:BaCO3+2H+=Ba2++CO2↑+H2O,加入氨水,调节pH为8,Fe3+完全沉淀时的pH为3.2,只有Fe3+完全沉淀,滤渣Ⅰ为Fe(OH)3,溶液中主要含Ca2+、Mg2+、Ba2+,加入氢氧化钠调节pH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,因此Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;溶液中主要含Ca2+、Ba2+,加入H2C2O4,得到滤渣ⅢCaC2O4↓,除去Ca2+,蒸发浓缩冷却结晶得到BaCl22H2O,据此分析解答。
(1)化学反应的速率与反应物的接触面积有关,矿石用盐酸浸取前需充分研磨,可以增大反应物的接触面积,增大反应速率,故答案为:增大接触面积,使反应速率加快;
(2)根据上述Fe3+完全沉淀时的pH为3.2,加入氨水,调pH为8,Fe3++3NH3H2O=Fe(OH)3↓+3NH4+,Fe3+完全沉淀,滤渣I为Fe(OH)3,若要除去Mg2+和Fe3+,则需要使Fe3+和Mg2+完全形成沉淀,但同时不能沉淀Ca2+,根据表中数据分析,应调节pH范围在11.1<pH<11.9;溶液中主要含Ca2+、Ba2+,Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,易形成CaC2O4沉淀,加入H2C2O4时应避免过量,防止CaC2O4沉淀完全后,过量的H2C2O4会导致生成BaC2O4沉淀,使产品的产量减少,故答案为:Fe(OH)3;11.1<pH<11.9;H2C2O4过量会导致生成BaC2O4沉淀,BaCl22H2O的产量减少;
(3)向有CaCO3固体的溶液中加入高浓度的BaCl2溶液,有BaCO3沉淀生成,发生沉淀的转化,由CaCO3转化为BaCO3,则反应的离子方程式为CaCO3(s)+Ba2+(aq) BaCO3(s)+Ca2+(aq),该反应的化学平衡常数为K=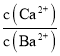 =
= =
=![]() =0.5,故答案为:CaCO3(s)+Ba2+(aq) BaCO3(s)+Ca2+(aq);0.5;
=0.5,故答案为:CaCO3(s)+Ba2+(aq) BaCO3(s)+Ca2+(aq);0.5;
(4)①高锰酸钾溶液具有氧化性,只能盛放在酸式滴定管中;高锰酸根离子被还原生成的锰离子为无色,当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色由无色变为红色,且半分钟不褪色,说明达到滴定终点,故答案为:酸式滴定管;由无色变为红色,且半分钟不褪色;
②滴定管示数从上到下示数不断增大,根据图示,滴定管读数为9.80mL,消耗KMnO4溶液体积为8.00mL,设BaCl22H2O的纯度为α,
5BaCl22H2O~5H2C2O4~2KMnO4
5×244g 2mol
2.5gα 0.05mol/L×8×10-3×![]() L
L
![]() =
=![]() ,解得:α=97.6%,故答案为:97.6%。
,解得:α=97.6%,故答案为:97.6%。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列反应中属于水解反应的是( )
A.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
B.2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
C.CH3CH2Br+NaOH![]() CH3CH2OH+NaBr
CH3CH2OH+NaBr
D.CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宋代张杲《医说》引《集验方》载:每每外出,用雄黄桐子大,在火中烧烟薰脚绷、草履、领袖间,以消毒灭菌,防止疫菌通过衣物的接触而传染。雄黄的结构如图所示,下列说法错误的是
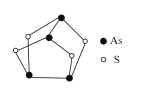
A.雄黄中硫的价态为-2价
B.古代熏蒸的消毒原理与H2O2、酒精相同
C.佩戴药剂香囊是中医独特的防疫措施
D.生活中也可使用火、盐水消毒器具
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种极易溶于水且几乎不与冷水反应的黄绿色气体(沸点11℃),实验室制备纯净ClO2溶液的装置如图所示:

已知下列反应:NaClO3+HCl→NaCl+ClO2+Cl2+H2O;NaClO2+HCl→NaCl+ClO2+H2O;NaClO2+Cl2→NaCl+ClO2(均未配平)。下列说法正确的是
A.a中通入的N2可用CO2或SO2代替B.b中NaClO2可用饱和食盐水代替
C.c中广口瓶最好放在冰水浴中冷却D.d中吸收尾气后只生成一种溶质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物PA66的合成路线如下:
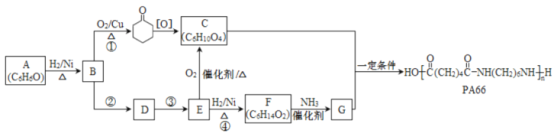
已知: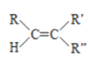
![]() RCHO+
RCHO+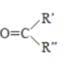
(1)A属于芳香化合物,其结构简式是____________。
(2)①的化学方程式是______________。
(3)D的结构简式是________________。
(4)④的化学方程式是______________。
(5)反应①~④中属于氧化反应的是____________(填序号)。
(6)C和G生成PA66的化学方程式是_____________。
(7)![]() 有多种同分异构体,符合下列条件的有_________种,其中任意一种同分异构体的结构简式是________。
有多种同分异构体,符合下列条件的有_________种,其中任意一种同分异构体的结构简式是________。
i. 为链状化合物且无支链; ii. 为反式结构; iii. 能发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬、硼的合金及其化合物用途非常广泛。回答下列问题:
(1)基态Cr原子核外电子的排布式是[Ar] ___;基态硼原子中占据最高能级的电子云轮廓图为____形。
(2)铬的配合物有氯化三乙二胺合铬![]() 和三草酸合铬酸铵{(NH4)3[Cr(C2O4)3]}等。
和三草酸合铬酸铵{(NH4)3[Cr(C2O4)3]}等。
①配体en表示NH2CH2CH2NH2,其中碳原子的杂化方式是____。
②NH4+空间构型为____,与其键合方式相同且空间构型也相同的含硼阴离子是_____ 。
③C、N、O三种元素第一电离能由小到大的顺序为 ___;![]() 含有三个五元环,画出其结构:_______________。
含有三个五元环,画出其结构:_______________。
(3)硼酸[H3BO3或B(OH)3]为白色片状晶体,熔点为171℃。下列说法正确的是___填字母)。
A.硼酸分子中,∠OBO的键角为120° B.硼酸分子中存在σ键和π键
C.硼酸晶体中,片层内存在氢键 D.硼酸晶体中,片层间存在共价键
(4)2019年11月《EurekAlert》报道了铬基氮化物超导体,其晶胞结构如图所示:

由三种元素Pr(镨)、Cr、N构成的该化合物的化学式为 ___。
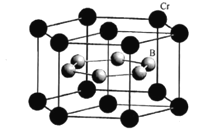
(5)CrB2的晶胞结构如图所示,六棱柱底边边长为acm,高为c cm,阿伏加德罗常数的值为NA,CrB2的密度为 ___gcm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国的稀土资源十分丰富,有开采价值的储量居世界第一。某实验小组拟利用含铝、硅、铁等杂质的氟碳钵矿(主要成分为CeFCO3)制备三氯化铈,设计如图所示流程:
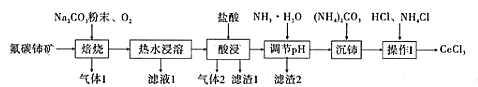
已知:①Ce2O3在加热条件下能被氧气氧化,生成难溶于水、具有强氧化性的CeO2。
②M(CeCl3)=246.5g/mol,在水溶液中Ce4+能被还原成Ce3+。
③0.1mol·L-1金属阳离子形成氢氧化物沉淀的pH如下:
金属阳离子 | Fe3+ | Ce3+ | Al3+ |
开始沉淀的pH | 1.5 | 7.6 | 3.4 |
沉淀完全的pH | 2.8 | 9.4 | 4.7 |
回答下列问题:
(1)氟碳铈矿中铈的化合价为______,滤渣1的化学式为__________。
(2)焙烧氟碳铈矿生成CeO3的化学方程式是____________。
(3)酸浸时产生气体2的离子反应方程式是_______。
(4)为将铝、铁以滤渣2除去,用NH3·H2O调节酸浸后溶液的pH最大不能超过______。
(5)将沉铈得到的Ce2(CO3)3·nH2O洗涤干净后继续进行操作I,简述如何证明Ce2(CO3)3·nH2O已经洗涤干净________。
(6)操作I是将得到的Ce2(CO3)3·nH2O加盐酸至沉淀完全溶解,先经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到CeCl3·7H2O,再将该晶体与NH4Cl固体隔绝空气共热,得到无水CeCl3。其中,NH4Cl的作用是___________。
(7)产品纯度测定:准确称取CeCl3产品0.3750g于锥形瓶中,加入合适的氧化剂将Ce3+恰好完全氧化为Ce4+,再用0.1000mol/L的(NH4)2Fe(SO4)2 标准溶液滴定至终点,重复3次实验,标准液的消耗体积分别为12.48mL、12.50mL、12.52mL。求该样品的质量分数为_______(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究一溴环己烷(![]() )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是( )
A. 甲 B. 乙 C. 丙 D. 上述实验方案都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾离子电池资源丰富,在非水基电解液中具有更高的离子导电率等优点。一种钾离子电池的工作原理如图所示,已知该电池负极在KC24-KC16-KC8之间变化,正极在K2MnFe(CN)6-KMnFe(CN)6-MnFe(CN)6之间变化,下列说法不正确的是( )
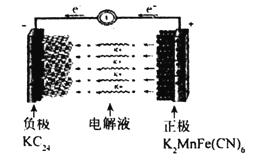
A.如图所示为钾离子电池的放电过程
B.放电时负极可发生反应:2KC8-e-=KC16+K+
C.充电时正极反应式为K2MnFe(CN)6-e-=KMnFe(CN)6+K+
D.若充电前正负极质量相同,则充电时每转移0.lmole-,理论上正负极质量差将增加7.8g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com