
分析 (1)由题给信息可知Fe2+转化为Fe3+而中毒,服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+;
(2)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性;
B.亚硝酸根离子和银离子反应生成白色沉淀,氯离子和银离子反应生成白色沉淀;
C.酸性条件下,亚硝酸根离子能被碘离子还原生成一氧化氮,同时生成碘单质;
D.亚硝酸根离子和银离子反应生成白色沉淀,氯离子和银离子反应生成白色沉淀,亚硝酸银溶于硝酸;
(3)把酸性高锰酸钾溶液滴入到NaNO2溶液中,观察到紫色褪色,同时生成NO3-和Mn2+,二者发生氧化还原反应;
(4)要使产物纯净,必须物质间发生反应后,没有杂质生成;
(5)根据得失电子数相等配平反应方程式,注意依据代数和为0判断元素的化合价;
(6)依据高铁酸根具有强的氧化性,以及反应生成的三价铁离子能够水解生成氢氧化铁胶体的性质解答.
解答 解:(1)服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+,Fe元素化合价降低,被氧化,则维生素具有还原性,而亚硝酸盐,会导致Fe2+转化为Fe3+,说明亚硝酸盐具有氧化性,在反应中为氧化剂,所以维生素C是还原剂,
故答案为:D;
(2)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,相同物质的量浓度的两种溶液的pH不同,所以可以用测定这两种溶液的pH值鉴别,故A不选;B.亚硝酸根离子和银离子反应生成亚硝酸银白色沉淀,氯离子和银离子反应生成白色氯化银沉淀,反应现象相同,所以不可以用AgNO3试剂来区别,故B选;
C.在酸性条件下,亚硝酸钠和碘离子反应方程式为2NO2-+2I-+4H+=2NO↑+I2+2H2O,碘遇淀粉变蓝色,氯离子和碘离子不反应,所以反应现象不同,所以可以用酸性条件下的KI淀粉试液来区别,故C不选;
D.亚硝酸根离子和银离子反应生成亚硝酸银白色沉淀,亚硝酸银和硝酸反应生成硝酸银和亚硝酸,白色沉淀溶解,氯离子和银离子反应生成不溶于硝酸的白色沉淀,反应现象不同,所以可以用AgNO3和HNO3两种试剂来区别,故D不选;
故答案为:B;
(3)酸性高锰酸钾溶液滴入到NaNO2溶液中,观察到紫色褪色,同时生成NO3-和Mn2+,反应的离子方程式为:6H++5NO2-+2MnO4-═NO3-+2Mn2++3H2O;
故答案为:6H++5NO2-+2MnO4-═NO3-+2Mn2++3H2O;
(4)A.氯气有氧化性,能氧化二价铁离子生成三价铁离子,但同时有氯离子生成,引入杂质离子,故A错误;
B.铁与稀硫酸反应生成二价铁离子,不能把二价铁离子转化为三价铁离子,故B错误;
C.双氧水能氧化二价铁离子生成三价铁离子,同时有水生成,水是原溶液的成分,所以不是杂质,故C正确;
D.硝酸能氧化二价铁离子生成三价铁离子,但溶液中还有杂质硝酸根离子,故D错误;
故答案为:C;
(5)FeSO4+K2O2→K2FeO4+K2O+K2SO4+O2↑,该反应,FeSO4中Fe的化合价为+2价,K2FeO4中Fe的化合价为+6价,所以一个氯化亚铁分子失去4个电子;K2O2中O的化合价为-1价,O2中O的化合价为0价,一个K2O2分子失去2个电子生成氧气;K2O2中O的化合价为-1价,K2FeO4和K2O中O元素的化合价为-2价,所以一个K2O2失去2个电子,该方程式中得失电子的最小公倍数为6,所以该方程式的计量数分别为2、6、2、2、2、1,即方程式为2FeSO4+6K2O2=2K2FeO4+2K2O+2K2SO4+1O2↑,
故答案为:2、6、2、2、2、1;
(6)高铁酸钾( K2FeO4)中Fe的化合价是+6价,具有强氧化性,能杀菌消毒,其还原产物Fe3+水解生成氢氧化铁胶体,能吸附水中杂质,所以高铁酸钾作为水处理剂发挥的作用是净水、杀菌消毒;
故答案为:净水、杀菌消毒.
点评 本题考查综合考查铁盐和亚铁盐的相互转化,亚硝酸盐的性质,注意二价铁离子和三价铁离子的检验是高考的热点,涉及了化学方程式的配平,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a2<a1<197 | B. | 2a2>a1>197 | C. | 2a2=a1>197 | D. | 2a2=a1=197 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
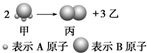 如图所示:已知甲、乙、丙常温下都为气体.2mol甲分子反应生成1mol丙和3mol乙,
如图所示:已知甲、乙、丙常温下都为气体.2mol甲分子反应生成1mol丙和3mol乙,查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠是银白色金属,质软,熔点相对较低,密度比水小 | |
| B. | 大量的钠着火时可以用沙扑灭,不能用水或泡沫灭火剂灭火 | |
| C. | 金属钠在空气中长期放置,最终变为碳酸钠 | |
| D. | Na2O和Na2O2都能由金属钠和氧气化合生成,Na2O和Na2O2氧的价态也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com