
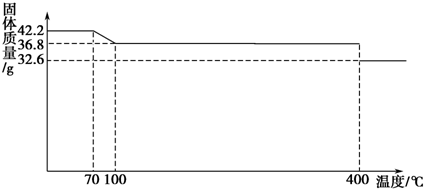
分析 (1)根据图象中数据通过计算确定150℃时固体物质的组成及化学式;
(2)与酸反应放出极毒的氰化氢(HCN)气体,400℃分解;
(3)若是等浓度,反应后生成HCN,溶液显示酸性;再根据电离常数公式求出HCN的电离常数;
(4)催化剂的特点,恢复原来状态,Fe3+→Fe2+;可以降低SO2的污染,同时制得硫酸.
解答 解:(1)K4[Fe(CN)6]•3H2O的相对分子质量为422,42.2gK4[Fe(CN)6]•3H2O的物质的量为:$\frac{42.2g}{422g/mol}$=0.1mol,0.1molK4[Fe(CN)6]•3H2O中含有0.3mol水,含有结晶水的质量为:18g/mol×0.3mol=5.4g,完全失去结晶水时的质量为:42.2g-5.4g=36.8g;根据曲线可知,100℃时K4[Fe(CN)6]•3H2O中结晶水完全失去变成K4[Fe(CN)6],之后直至加热到400℃K4[Fe(CN)6]开始分解,所以150℃时固体物质的主要成分为:K4[Fe(CN)6],
故答案为:K4[Fe(CN)6];
(2)由于“与酸反应放出极毒的氰化氢(HCN)气体”,再结合根据热重曲线,400℃分解,故应避免与醋、西红柿等酸性物质一起烹饪;控制烹饪温度不超过400℃,
故答案为:应避免与醋、西红柿等酸性物质一起烹饪;控制烹饪温度不超过400℃;
(3)KCN+HCl═KCl+HCN,若是等浓度,生成HCN应该呈酸性,而反应后PH=7呈中性,说明KCN有剩余(KCN水解呈碱性),所以a>0.01mol/L;
HCN═H++CN-Ka=c(H+)×c(CN-)/c(HCN),溶液呈中性则[H+]=10-7 mol/L,c(CN-)=$\frac{a-0.01}{2}$(等体积混合,原浓度都减半)c(HCN)=$\frac{0.01}{2}$,带入公式,Ka=10-7•(a-0.01)/0.01=(100a-1)×10-7 mol•L-1,故答案为:>;(100a-1)×10-7 mol•L-1 ;
(4)根据催化剂的特点,另一个反应一定有Fe3+→Fe2+,反应方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
点评 本题考查化学方程式有关计算、氧化还原反应、弱电解质的电离等知识点,综合性较强,明确物质性质是解本题关键,难点是(3)题计算,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com