
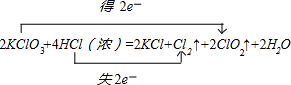 ,生成2molClO2转移了2mol电子,则生成1molClO2时转移电子的物质的量为:2×
,生成2molClO2转移了2mol电子,则生成1molClO2时转移电子的物质的量为:2×| 1 |
| 2 |
| 1 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化碳增多使太阳辐射到地球表面的能量增多 |
| B、二氧化碳等气体能释放能量,使大气层的温度升高 |
| C、氟氯烃等大量排放,破坏臭氧层引起的 |
| D、二氧化碳、甲烷等温室气体产生温室效应,使大气温度升高,加速冰层融化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
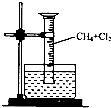 某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.请回答有关问题:
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.请回答有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:
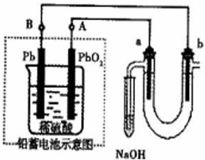 用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是 ( )(填序号)
用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极).下列说法中正确的是 ( )(填序号)| A、铅蓄电池负极的反应式为:Pb-2e-=Pb2+ |
| B、铅蓄电池放电时,B极质量减轻,A极质量增加 |
| C、铅蓄电池充电时,A极应与外电源负极相连 |
| D、电解苦卤水时,a电极首先放电的是Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 强电解质 | Fe | NaCl | BaSO4 | HNO3 |
| 弱电解质 | CH3COOH | NH3 | H2CO3 | Fe(OH)3 |
| 非电解质 | 蔗糖 | CaCO3 | C2H5OH | H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com