
【题目】以0.10mol/L的氢氧化钠溶液滴定同浓度某一元酸HA的滴定曲线如图所示(![]() )。下列表述错误的是( )
)。下列表述错误的是( )
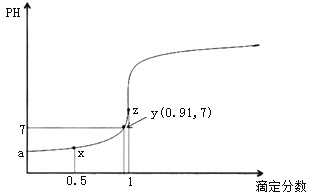
A.z点后存在某点,溶液中的水的电离程度和y点的相同
B.a约为3.5
C.z点处,![]()
D.x点处的溶液中离子满足:![]()
【答案】D
【解析】
A.z点滴定分数为1,即恰好完全反应,此时溶液中溶质为NaA,水的电离程度最大, z点之前溶液存在HA抑制水的电离,z点之后溶液中存在NaOH抑制水的电离,所以z点后存在某点,溶液中的水的电离程度和y点的相同,故A正确;
B. HA的电离平衡常数 ,设HA的量为1,y点的滴定分数为0.91,pH=7,溶液中电荷守恒得到c(Na+)=c(A-)=0.91,则,c(HA)=1-0.91=0.09,平衡常数K=
,设HA的量为1,y点的滴定分数为0.91,pH=7,溶液中电荷守恒得到c(Na+)=c(A-)=0.91,则,c(HA)=1-0.91=0.09,平衡常数K=![]() ,设0.1mol/L的HA溶液中c(H+)=amol/L,则K=
,设0.1mol/L的HA溶液中c(H+)=amol/L,则K=![]() ,解得a约为10-3.5mol/L,pH约为3.5,故B正确;
,解得a约为10-3.5mol/L,pH约为3.5,故B正确;
C. z点滴定分数为1,即恰好完全反应,此时溶液中溶质为NaA,根据电荷守恒可知![]() ,此时溶液呈碱性,即氢氧根浓度大于氢离子浓度,所以
,此时溶液呈碱性,即氢氧根浓度大于氢离子浓度,所以![]() ,故C正确;
,故C正确;
D. x点处的溶液中溶质为HA和NaA,且二者物质的量相等,存在电荷守恒:![]() ,物料守恒:
,物料守恒:![]() ;二式消掉钠离子可得:
;二式消掉钠离子可得:![]() ,此时溶液呈酸性,即c(H+)> c(OH-),所以
,此时溶液呈酸性,即c(H+)> c(OH-),所以![]() ,故D错误;
,故D错误;
故答案为D。


科目:高中化学 来源: 题型:
【题目】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)=2H2O(l) △H1=-571.8kJ· mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
(1)甲醇蒸汽完全燃烧的热化学方程式为_____________。
(2)反应②中的能量变化如下图所示,则△H2=______(用E1和E2表示)。

(3)H2(g)的燃烧热为__________ kJ· mol-1。
(4)请你分析H2(g)作为能源比甲醇蒸汽作为能源的优点:__________________(写出一点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成两者溶液的体积之和),下列说法正确的是( )

A.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
B.点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1
D.点⑤所示溶液中:c(OH-)= c(H+)+ c(HC2O4-)+ c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(举一反三)A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:

(1)若A是淡黄色固体,C、D是氧化物,C是造成酸雨的主要物质,但C也有其广泛的用途,写出其中的两个用途:_____________________________。
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。B与C在一定条件下反应生成的A是大气的主要成分,写出该反应的化学方程式:_____________________________。
(3)若D物质具有两性,②、③反应均要用强碱溶液,④反应时通入过量的一种引起温室效应的主要气体。判断单质A的元素在周期表中的位置:___________________________。
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式:_______________________________。
D的化学式是________。
(5)若A是应用最广泛的金属。④反应用到A,②、⑤反应均用到同一种非金属单质。C的溶液用于蚀刻印刷铜电路板,写出该反应的离子方程式:_________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
A.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
B.将水加热,KW增大,pH不变
C.向水中加入氨水,平衡逆向移动,c(OH-)降低
D.向水中加入固体醋酸钠,平衡逆向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应X(g)+3Y(g)![]() 2Z(g)达到平衡的标志是
2Z(g)达到平衡的标志是
①Z生成的速率与Z分解的速率相等 ②单位时间生成a mol X,同时生成3a mol Y
③X、Y、Z的浓度不再变化 ④X、Y、Z的分子数比为1:3:2
⑤X、Y、Z的浓度相等 ⑥X、Y、Z的质量不再发生变化
A.①③⑥B.①②③C.①②⑤⑥D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:

①反应的热化学方程式为:_______________________________________。
②已知:C(s)+H2O(g)=CO(g)+H2(g)ΔH=+131 kJ·mol-1,则C(s)+CO2(g)=2CO(g)ΔH=________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则1/2N2(g)+3/2H2(g)===NH3(g)ΔH=___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g)![]() 2NO(g),△H>0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
2NO(g),△H>0,已知该反应在240℃,平衡常数K=64×10-4。请回答:
(1)某温度下,向2L的密闭容器中充入N2和O2各1mol,5分钟后O2的物质的量为0.5mol,则N2的反应速率为______。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志______.
A.消耗1molN2同时生成1molO2![]() 混合气体密度不变
混合气体密度不变
C.混合气体平均相对分子质量不变D.2v正(N2)=v逆(NO)
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是______(填字母序号)。

(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态![]() 与原平衡状态相比,此时平衡混合气中NO的体积分数______
与原平衡状态相比,此时平衡混合气中NO的体积分数______![]() 填“变大”、“变小”或“不变”
填“变大”、“变小”或“不变”![]()
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应______(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com