
����Ŀ����ɫ����ˮ����KaCub(C2O4)c��H2O(ͭԪ��Ϊ+2��)����ɿ�ͨ������ʵ��ȷ����
����٣���ȡһ����������Ʒ������ƿ�У���������2 mol��L-1ϡ���ᣬ��ʹ��Ʒ�ܽ⡣�ټ���30 mLˮ���ȣ���0.0200 mol��L-1KMnO4��Һ�ζ����յ㣬����KMnO4��Һ12.00 mL(![]() �Ļ�ԭ����ΪMn2+)��
�Ļ�ԭ����ΪMn2+)��
����ڣ���ּ��ȵζ������Һ����ȴ����pH�����������KI���壬��Һ��Ϊ��ɫ��������ɫ����CuI��������Ӧ2Cu2++4I-=2CuI��+I2
����ۣ���������������Һ��ָʾ������0.0200 mol��L-1Na2S2O3����Һ�ζ����յ㣬���ı���Һ15.00 mL��������ӦI2+2![]() =2I-+
=2I-+![]()
(1)���������δ�Եζ������Һ���м��ȣ�������Cu2+�����ʵ�����____(����ƫ��������ƫС�� ����������) ��
(2)������еζ��յ��������___________��
(3)ͨ������ȷ��a��b��c=___________��(д���������)
���𰸡�ƫ�� ��Һ��ɫ��ȥ 2��1��2
��������
(1)���ȿɴ�ʹMnO4-�ֽ����Mn2+��Ӧ������Ժ���ʵ��������ţ�
(2)����I2��������Һ��Ϊ��ɫ�жϵζ��յ��ʵ������
(3)����MnO4-����Һ�����ʵ�������C2O42-�����ʵ��������ݷ�Ӧ����Na2S2O3����Һ���������Cu2+�����ʵ����������ݵ���غ�ɼ���K+�����ʵ������ټ�����������ӵ����ʵ����������ȣ����õ�a��b��c�ı�ֵ��
(1)������������KMnO4����ǿ�������ԣ�������I-����������ԭ��Ӧ����I2�����������δ�Եζ������Һ���м��ȳ�ȥMnO4-��MnO4-����������Ϊ�ⶨCu2+�������I-����Ӧ����I2��ʹ����I2�����ʵ������࣬���²����Cu2+�ĺ���ƫ��
(2)����Һ�з�����Ӧ��2Cu2++4I-=2CuI��+I2���Ե�����Һ��ָʾ��������I2��������Һ��Ϊ��ɫ��������0.0200 mol��L-1Na2S2O3����Һ���еζ�ʱ��������Ӧ��I2+2S2O32-=2I-+S4O62-�����ű���Һ�ļ��룬I2Ũ�����ͣ���Һ��ɫ��dz�����μ����һ��Na2S2O3����Һʱ����Һǡ������ɫ��Ϊ��ɫ���Ұ�����ڲ��ٱ�Ϊ��ɫ��˵����ʱ��Ӧ�ﵽ�˵ζ��յ�ʵζ��յ��ʵ�������ǣ���Һ��ɫ��ȥ��������ڲ��ٱ�Ϊ��ɫ��
(3)���ݵ����غ��֪��ϵʽ��5C2O42-��2MnO4-������n(C2O42-)=![]() n(MnO4-)=
n(MnO4-)=![]() ��0.0200 mol/L��12.00 mL��10-3 L/mL=6.000��10-4 mol��
��0.0200 mol/L��12.00 mL��10-3 L/mL=6.000��10-4 mol��
���ݷ���ʽ2Cu2++4I-=2CuI��+I2��I2+2S2O32-=2I-+S4O62-���ɵù�ϵʽ��2Cu2+��I2��2S2O32-������n(Cu2+)=2n(I2)=n(S2O32-)=0.0200 mol/L��15.00 mL��10-3 L/mL=3.000��10-4 mol��
���ݵ���غ�ɵã�
n(K+)+2n(Cu2+)=2n(C2O42-)����n(K+)+2��3.000��10-4 mol=2��6.000��10-4 mol�����n(K+)=6.000��10-4 mol������n(K+)��n(Cu2+)��n(C2O42-)=2��1��2����a��b��c=2��1��2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�ĵ���ƽ��������ͼ��ʾ������˵����ȷ����
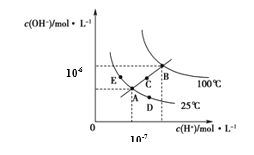
A.ͼ�����KW��Ĺ�ϵ��B>C>A=D=E
B.����A�㵽C�㣬�ɲ����¶Ȳ���ʱ��ˮ�м�������H2SO4 �ķ���
C.����A�㵽D�㣬�ɲ�����ˮ�м�������NaOH�ķ���
D.������B���¶�ʱ����pH=2��������pH=12��KOH�������Ϻ���Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˲ⶨij�л���A�Ľṹ��������ʵ�飺
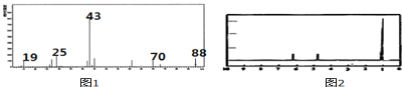
�ٽ�4.4g���л�����ȫȼ�գ����� 0.2mol CO2��3.6gˮ��
���������Dzⶨ����Է�������������ͼ1������ͼ����A�ĺ˴Ź���������ͼ2��
�Իش��������⣺
��1���л���A����Է���������__________
��2���л���A�ķ���ʽ��_________
��3���л���A��ʵ��ʽ��________
��4����������Ϸ���A�Щ�COOH��2����CH3���л���A�Ľṹ��ʽ ____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��֪ˮ�ı�����Ϊ4.18��10-3 kJg-1��-1��10g�����O2����ȫȼ��������̬SO2���ų���������ʹ500g H2O���¶���18������62.4�棬����Ƶ�ȼ����Ϊ__���Ȼ�ѧ����ʽΪ_��
(2)����P(s)��Cl2(g)������Ӧ����PCl3(g)��PCl5(g)����Ӧ�������£�
2P(s)+3Cl2(g)��2PCl3(g)��H����612kJ/mol
2P(s)+5Cl2(g)��2PCl5(g)��H����798kJ/mol
��̬PCl5������̬PCl3��Cl2���Ȼ�ѧ����ʽΪ___��
(3)��50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺
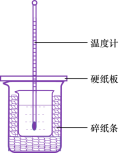
�ٴ�ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ�����Ʒ��____��
���ձ���������ֽ����������_��
�۴��ձ����粻��Ӳֽ�壬��õ��к�����ֵ_(����ƫ��ƫС����Ӱ����)��
�������60mL0.50mol/L������50mL0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ����ų�������_________(������ȡ��������)�������к���_(������ȡ��������)��
������ͬŨ�Ⱥ�����İ�ˮ(NH3H2O)����NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ��__��(����ƫ��������ƫС��������Ӱ����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ�����ͼʾ���ó��Ľ�����ȷ����
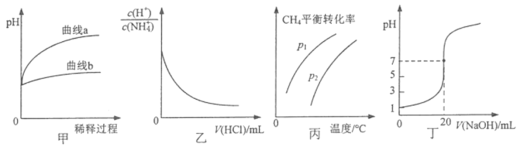
A.ͼ�ױ�ʾ��ͬpH������ʹ����ˮϡ������pH�ı仯��������a��������
B.ͼ�ұ�ʾ�¶Ȳ��䣬��0.1mol��L-1NH4Cl��Һ�еμ�0.1mol��L-1����ʱ����Һ��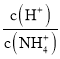 ����������ı仯��ϵ
����������ı仯��ϵ
C.ͼ����ʾ�ܱ�������CH4(g)+ H2O(g)CO(g)+3H2(g)����ƽ��ʱ��CH4��ƽ��ת������ѹǿ���¶ȵı仯��ϵ���ߣ�˵��P1<P2
D.ͼ����ʾ0.1000mol��L-1NaOH��Һ�ζ�20.00 mL 0.1000mol��L-1������Һ�ζ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��100��ʱ���ڲ�ͬ�������Ӵ����£��������⾭��24h�ķֽ������±���ʾ��
���� | ��������mg��L��1�� | �ֽ���/% | ���� | ��������mg��L��1�� | �ֽ���/% |
�� |
| 2 | Fe2�� | 1.0 | 15 |
Al3�� | 10 | 2 | Cu2�� | 0.1 | 86 |
Zn2�� | 10 | 10 | Cr3�� | 0.1 | 96 |
�����й�˵����ȷ����
A.��ʹ��������ֽⷴӦ��ܽ�������������Al3��
B.��������ʹƽ���ƶ�����߹�������ķֽ���
C.������������м���ˮ����������ķֽ����ʼӿ�
D.�õ���H2O2��O2ʱ���������ֽ���ȣ�������������KMnO4��Һ�ɵõ�����O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��N��ԭ������������������ֶ���������Ԫ�����������γ�һ���л���(�ṹ��ͼ)������Ԫ��ԭ�ӵ�����������֮��Ϊ24��Z��Nͬ���壬M�Ƿǽ�������ǿ��Ԫ�أ�����˵���������
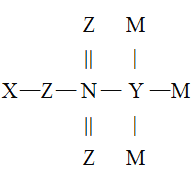
A.��������ϼۣ�N��Y��X
B.Z��N�ɷֱ���X�γɵȵ������Ļ�����
C.ԭ�Ӱ뾶��N��Z��Y��M��X
D.Y��N������ij�ֺ�������ʹ����KMnO4��Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����Ƶ�����ˮ�ⷴӦ��ͼ��ʾ���г�װ��ʡ�ԣ�������˵��������ǣ� ��
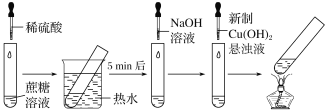
A.ϡ�������ˮԡ���ܼӿ�����ˮ������
B.�μ�NaOH��Һ��Ŀ���ǵ���Һ��pH������
C.���������ں��Թ������ɺ�ɫ����
D.ʵ������֤������ˮ���л�ԭ����������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com