
【题目】25℃时,向20. 00 mL 0.1 mol/L H2X溶液中滴入0.1 mo1/L NaOH溶液,溶液中由水电离出的c水(OH-) 的负对数[一lgc水(OH-)]即pOH水-与所加NaOH溶液体积的关系如图所示。下列说法中正确的是

A.水的电离程度:M>PB.图中P点至Q点对应溶液中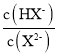 逐渐增大
逐渐增大
C.N点和Q点溶液的pH相同D.P点溶液中![]()
【答案】D
【解析】
-1g c水(OH-)越小,c水(OH-)越大,酸或碱抑制水电离,含有弱离子的盐促进水电离,且酸中c(H+)越大、碱中c(OH-)越大,其抑制水电离程度越大,则 c水(OH-)越小,据此分析解答。
A.M点水电离出的c水(OH-)为10-11.1mol/L,P点水电离出的c水(OH-)为10-5.4mol/L,水的电离程度M<P,故A错误;
B.水解平衡常数只与温度有关,P点至Q点溶液中c(OH-)依次增大,则 ![]() =
=![]() ×
×![]() =
=![]() 依次减小,故B错误;
依次减小,故B错误;
C.N点到Q点,加入的NaOH逐渐增多,溶液的pH逐渐增大,故C错误;
D.P点溶质为Na2X,溶液中存在质子守恒,c(OH-)=c(H+)+c(HX-)+2c(H2X),故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图

下列关于该高分子的说法正确的是
A. 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B. 完全水解产物的单个分子中,含有官能团―COOH或―NH2
C. 氢键对该高分子的性能没有影响
D. 结构简式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C均为短周期元素,它们在周期表中的位置如下图所示。已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B.C两元素的核电荷数之和是A元素原子序数的4倍。下列说法正确的是
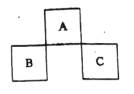
A.C位于元素周期表中第3周期第VA族
B.B的非金属性比A强
C.C的气态氢化物的稳定性比B的强
D.原子半径:r(B)<r(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮(NH3、NH4+等)是一种重要污染物,可利用合适的氧化剂氧化去除。
(1)氯气与水反应产生的HClO可去除废水中含有的NH3。
已知:NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
则反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=________kJ·mol-1。
(2)在酸性废水中加入NaCl进行电解,阳极产生的HClO可氧化氨氮。电解过程中,废水中初始Cl-浓度对氨氮去除速率及能耗(处理一定量氨氮消耗的电能)的影响如图所示。
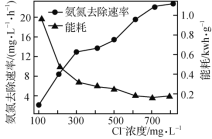
①写出电解时阳极的电极反应式:________________。
②当Cl-浓度减小时,氨氮去除速率下降,能耗却增加的原因是____________________________。
③保持加入NaCl的量不变,当废水的pH低于4时,氨氮去除速率也会降低的原因是____________________________。
(3)高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,该反应的离子方程式为________________________________。
②用K2FeO4氧化含氨氮废水,其他条件相同时,废水pH对氧化氨氮去除率及氧化时间的影响如图所示。当pH小于9时,随着pH的增大,氨氮去除率增大、氧化时间明显增长的原因是_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼铁混合精矿含有硼镁石[MgBO2(OH)、磁铁矿(Fe3O4)、磁黄铁矿(FexS)、品质铀矿(UO2)等,以该矿为原料制备MgSO4·H2O和硼酸(H3BO3)的工艺流程如下:
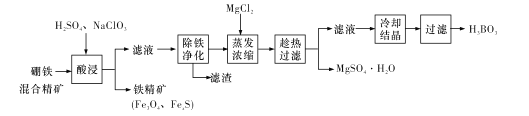
已知:![]() 在pH为4~5的溶液中生成UO2(OH)2沉淀。
在pH为4~5的溶液中生成UO2(OH)2沉淀。
回答下列问题:
(l)“酸浸”时,为了提高浸出率可采取的措施有:________ (至少答两个措施),该步骤中NaC1O3可将UO2转化为![]() ,则该反应的离子方程式为_____。
,则该反应的离子方程式为_____。
(2)“除铁净化”需要加入____(填化学式)把溶液pH调节至4~5,滤渣的成分是_______。
(3)“蒸发浓缩”时,加入固体MgC12的作用是 ___。
(4)铁精矿(Fe3O4、FexS)经过一系列加工后,可用于制备氢氧化铁固体。已知T℃,
![]() ,
,![]() ,
,![]() 回答下列问题:
回答下列问题:
①在T℃,假设Fe3+水解的离子方程式是:![]() ,则该条件下Fe3+水解反应的平衡常数K= __(用含以的字母表示)。
,则该条件下Fe3+水解反应的平衡常数K= __(用含以的字母表示)。
②在T℃向饱和Fe(OH)3、Fe(OH)2的混合溶液中,加入少量NaOH固体(忽略溶液体积变化),则溶液中的c(Fe2+)/c(Fe3+)会 __(填“变大”“变小”或“不变”),请结合相关数据推理说明:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型药物G合成路线如图所示:
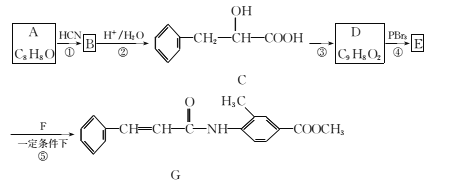
已知:Ⅰ.RCHO![]()
![]() (R为烃基);
(R为烃基);
Ⅱ.RCOOH![]()
![]() ;
;
Ⅲ. ![]() +RNH2
+RNH2![]()
![]()
请回答下列问题:
(1)A的名称为 ___,合成路线图中反应③所加的试剂和反应条件分别是______。
(2)下列有关说法正确的是 __(填字母代号)。
A. 反应①的反应类型为取代反应
B. C可以发生的反应类型有取代、加成、消去、加聚
C. D中所有碳原子可能在同一平面上
D. 一定条件下1 mol G可以和2 mol NaOH或者9 mol H2反应
(3)F的结构简式为____。
(4)C在一定条件下可以发生聚合反应生成高分子化合物,写出该反应的化学方程式 ______。
(5)D有多种同分异构体,同时满足下列条件的同分异构体有 ___种。
①属于芳香族化合物,且分子中含有的环只有苯环
②能发生银镜反应和水解反应
(6)参照G的上述合成路线,设计一条由乙醛和H2NCH(CH3)2为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度均为0.5molL-1氨水和KOH溶液分别滴入到体积均为20mL且浓度相同的AlCl3溶液中,测得溶液的导电率与加入碱的体积关系如图所示,下列说法中错误的是( )
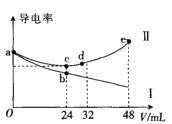
A.AlCl3溶液的物质的量浓度为0.2molL-1
B.根据图象可以确定导电率与离子种类有关
C.cd段发生的反应是Al(OH)3+OH-=AlO2-+2H2O
D.e点时溶液中的离子浓度:c(K+) =c(Cl-) +c(AlO2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列颜色变化与氧化还原无关的是( )
A.湿润的红色布条遇到氯气褪色
B.棕黄色的FeCl3饱和溶液滴入沸水中变红褐色
C.紫色酸性KMnO4溶液通入乙烯气体后褪色
D.浅黄色Na2O2固体露置于空气中逐渐变为白色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发新型储氢材料是开发利用氢能的重要研究方向。
(1)![]() 是一种储氢材料,可由
是一种储氢材料,可由![]() 和
和![]() 反应制得。
反应制得。
①基态Cl原子中,电子占据的最高电子层符号为 _______,该电子层具有的原子轨道数为 _______。
②Li、B、H元素的电负性由大到小的排列顺序为 ___________。
(2)金属氢化物是具有良好发展前景的储氢材料。
①LiH中,离子半径:Li+ ___________(填“>”“=”或“<”)H-。
②某储氢材料是短周期金属元素M的氢化物。M的部分电离能如表所示:
|
|
|
|
|
738 | 1451 | 7733 | 10540 | 13630 |
则M是 ______________ (填元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com