
【题目】氨氮(NH3、NH4+等)是一种重要污染物,可利用合适的氧化剂氧化去除。
(1)氯气与水反应产生的HClO可去除废水中含有的NH3。
已知:NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
则反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=________kJ·mol-1。
(2)在酸性废水中加入NaCl进行电解,阳极产生的HClO可氧化氨氮。电解过程中,废水中初始Cl-浓度对氨氮去除速率及能耗(处理一定量氨氮消耗的电能)的影响如图所示。
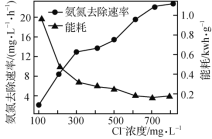
①写出电解时阳极的电极反应式:________________。
②当Cl-浓度减小时,氨氮去除速率下降,能耗却增加的原因是____________________________。
③保持加入NaCl的量不变,当废水的pH低于4时,氨氮去除速率也会降低的原因是____________________________。
(3)高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,该反应的离子方程式为________________________________。
②用K2FeO4氧化含氨氮废水,其他条件相同时,废水pH对氧化氨氮去除率及氧化时间的影响如图所示。当pH小于9时,随着pH的增大,氨氮去除率增大、氧化时间明显增长的原因是_________________。

【答案】2a+b Cl--2e-+H2O=HClO+H+ Cl-电解产生的HClO浓度低,氧化氨氮速率低,阳极OH-放电,消耗电能 当H+过大,HClO氧化Cl-产生Cl2从溶液中逸出,使HClO浓度减小 2NH3+2FeO42-+2H2O=2Fe(OH)3↓+N2↑+4OH- 随着pH的增大K2FeO4的稳定性增强,利用率提高,氨氮去除率高;但H+浓度减小,氧化性减弱,氧化时间增长
【解析】
(1)根据盖斯定律计算解答;
(2)①电解时阳极发生氧化反应,失电子,元素化合价升高,;结合题意据此分析电极反应式;
②结合阳极电极反应分析原因;
③阳极产生的HClO,具有氧化性,酸性条件下氧化性增强,不但可氧化氨氮,也可以氧化氯离子;
(3)高铁酸钾(K2FeO4)是一种高效氧化剂,可用于氨氮处理。K2FeO4在干燥空气中和强碱性溶液中能稳定存在。氧化剂的氧化性受溶液中的H+浓度影响较大。
①碱性条件下K2FeO4可将水中的NH3转化为N2除去,根据氧化还原反应电荷守恒和物料守恒书写反应的离子方程式;
②用K2FeO4氧化含氨氮废水,说明K2FeO4具有强氧化性,根据酸性强弱对氧化性的影响分析。
(1)已知:①NH3(aq)+HClO(aq)=NH2Cl(aq)+H2O(l) ΔH=a kJ·mol-1
②2NH2Cl(aq)+HClO(aq)=N2(g)+H2O(l)+3H+(aq)+3Cl-(aq) ΔH=b kJ·mol-1
根据盖斯定律:①×2+②可得反应2NH3(aq)+3HClO(aq)=N2(g)+3H2O(l)+3H+(aq)+3Cl-(aq)的ΔH=2a+b kJ·mol-1;
(2)①电解时阳极发生氧化反应,失电子,元素化合价升高,在酸性废水中加入NaCl进行电解,阳极产生的HClO,氯元素的化合价升高失电子,阳极电极反应式为:Cl--2e-+H2O=HClO+H+;
②阳极电极反应式为:Cl--2e-+H2O=HClO+H+,当Cl-浓度减小时,Cl-电解产生的HClO浓度低,氧化氨氮速率低,阳极OH-放电,消耗电能;
③阳极产生的HClO,具有氧化性,酸性条件下氧化性增强,当废水的pH低于4时,H+浓度过大,HClO氧化性增强,可氧化Cl-产生Cl2从溶液中逸出,使HClO浓度减小,氨氮去除速率也会降低;
(3)①碱性条件下K2FeO4可将水中的NH3转化为N2除去,铁元素化合价由+6价降低为+3价,碱性条件下应生成Fe(OH)3沉淀,氮元素化合价由-3价升高为0价,根据氧化还原反应电荷守恒和物料守恒,反应的离子方程式为2NH3+2FeO42-+2H2O=2Fe(OH)3↓+N2↑+4OH-;
②用K2FeO4氧化含氨氮废水,说明K2FeO4具有强氧化性,氧化性受溶液中的H+浓度影响较大,随着pH的增大K2FeO4的稳定性增强,利用率提高,氨氮去除率高;但H+浓度减小,氧化性减弱,氧化时间增长。


科目:高中化学 来源: 题型:
【题目】比亚迪公司开发了锂钒氧化物二次电池。电池总反应为V2O5+xLi![]() LixV2O5,下列说法正确的是
LixV2O5,下列说法正确的是
A.该电池充电时,锂电极与外加电源的负极相连
B.该电池放电时,Li+向负极移动
C.该电池充电时,阴极的反应为LixV2O5-xe-=V2O5+xLi+
D.若放电时转移0.2mol电子,则消耗锂的质量为1.4xg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化石墨烯基水凝胶是一类新型复合材料,常用 Hummers 法制备氧化石墨烯,具体方法为:将石墨粉和无水 NaNO3 混合后置于浓硫酸中并用冰浴冷却,再用 KMnO4 溶液进行氧化处理,最后用 H2O2 处理即可得到氧化石墨烯。请回 答下列问题。
(1)锗(Ge)元素与碳元素同族,基态 Ge 原子的外围电子排布式是_____。与锗同周期且基态原子未成对 电子数与 Ge 原子相同的元素有_____(用元素符号表示)。
(2)对氧化石墨烯进行还原可得到还原氧化石墨烯,二者的结构如图所示:
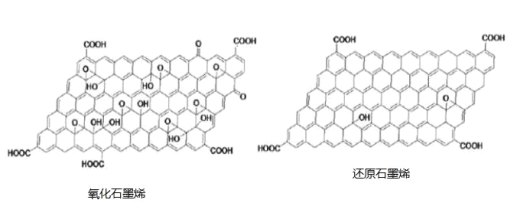
①还原石墨烯中碳原子的杂化形式是___________________ 。
②二者当中在水溶液中溶解度更大的是____________ (填物质名称),原因为__________________。
(3)NaNO3 中 NO3- 的空间构型为_____,写出两种与 NO3- 的互为等电子体的分子的分子式_____。
(4)金属钾晶体和金属锰晶体的三维空间堆积方式均为体心立方堆积。
①上述两种晶体原子在二维平面放置方式均为_____(填“密置层”或“非密置层”)。
②金属钾和金属锰的熔点分别为 63℃和 1244℃,金属锰的熔点高于金属钾熔点的原因为___________。
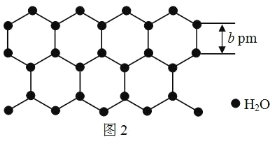
(5)中国科学家首次证明了二维冰的存在,二维冰是由两层六角冰无旋转堆垛而成,两层之间靠氢键连接,每个水分子与面内水分子形成三个氢键,与面外水分子形成一个氢键,二维冰结构的模型示意图的侧视图 如图 1 所示,厚度为 a pm,俯视图如图 2 所示,距离最近的两个水分子间的距离为 b pm,设阿伏加德罗常 数的值为 N,二维冰的密度是________________ g·cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
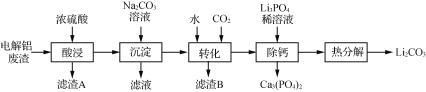
【题目】Li2CO3是生产锂电池的重要原料,电解铝废渣(主要含AlF3、LiF、NaF、CaO等物质)可用于制备Li2CO3。
已知:①Li2CO3的溶解度:0 ℃ 1.54 g;20 ℃ 1.33 g;80 ℃ 0.85 g。
②20 ℃,Ksp[Ca3(PO4)2]=2×10-33,Ksp(CaHPO4)=1×10-7。
(1)在加热条件下酸浸,反应生成能腐蚀玻璃的气体,写出AlF3发生反应的化学方程式:______。

(2)滤渣B的主要成分是________。
(3)“转化”后所得LiHCO3溶液中含有的Ca2+需要加入Li3PO4除去。除钙步骤中其他条件不变,反应相同时间,温度对除钙率和Li2CO3产率的影响如右图所示。
①随着温度升高最终Li2CO3的产率逐渐减小的原因是___________。
②当温度高于50 ℃时,除钙率下降的原因可能是__________________。
(4)热分解后,获得Li2CO3需趁热过滤的原因是_______________________。
(5)将酸浸时产生的气体通入Al(OH)3和Na2SO4溶液的混合物中可产生难溶物冰晶石(Na3AlF6),该反应的离子方程式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物Z常用于治疗心律失常,Z可由有机物X和Y在一定条件下反应制得,下列叙述正确的是
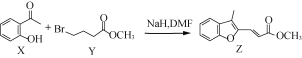
A.X中所有原子可能在同一平面内
B.X、Z均能与酸性KMnO4溶液反应
C.1 mol Y最多能与2 mol NaOH反应
D.室温下Z与足量Br2加成产物的分子中有2个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组由Cu(NO3)2溶液先制得Cu(NO3)2·3H2O晶体,然后在下图所示实验装置中(夹持及控温装置省略),用Cu(NO3)2·3H2O晶体和SOCl2制备少量无水Cu(NO3)2。已知:SOCl2的熔点为-105℃、沸点为76℃、遇水剧烈水解生成两种酸性气体。
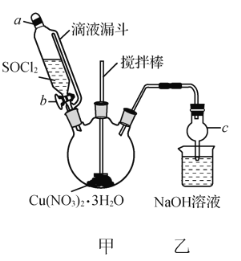
(1)由Cu(NO3)2溶液制得Cu(NO3)2·3H2O晶体的实验步骤包括蒸发浓缩、冷却结晶、抽滤等步骤。
①蒸发浓缩时当蒸发皿中出现______________________________(填现象)时,停止加热。
②为得到较大颗粒的Cu(NO3)2·3H2O晶体,可采用的方法是_______________(填一种)。
(2)①仪器c的名称是________。
②向三颈烧瓶中缓慢滴加SOCl2时,需打开活塞________(填“a”或“b”或“a和b”)。
(3)装置甲中Cu(NO3)2·3H2O和SOCl2发生反应的化学方程式为__________________________________。
(4)装置乙的作用是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20. 00 mL 0.1 mol/L H2X溶液中滴入0.1 mo1/L NaOH溶液,溶液中由水电离出的c水(OH-) 的负对数[一lgc水(OH-)]即pOH水-与所加NaOH溶液体积的关系如图所示。下列说法中正确的是

A.水的电离程度:M>PB.图中P点至Q点对应溶液中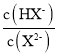 逐渐增大
逐渐增大
C.N点和Q点溶液的pH相同D.P点溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用所学知识,解决下列问题。
(1)AlCl3溶液呈___(填“酸”“中”或“碱”)性,原因是___(用离子方程式表示)。实验室配制AlCl3溶液时,常将AlCl3固体先溶于较浓的盐酸中,再用蒸熘水稀释到所需的浓度,目的是___。
(2)今有常温下五种溶液:CH3COONa溶液、NH4Cl溶液、NaOH溶液、氨水、NH4HSO4溶液。
①CH3COONa溶液pH___(填“>”“=”或“<” )7,若要使溶液的pH增大,可采取的措施是___。
②pH相等的NaOH溶液和CH3COONa溶液,分别稀释相同倍数后,NaOH溶液的pH___(填“>”“=”“<”)CH3COONa溶液。
③物质的量浓度均为0.1mol·L-1的三种溶液:A.NH4Cl溶液 B.NH4HSO4溶液 C.氨水,c(NH4+)由大到小的顺序为___(填字母)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com