
【题目】H3BO3(一元弱酸)可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )
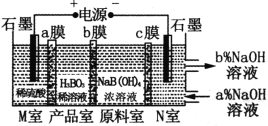
A.M室发生的电极反应式为:2H2O-4e-=O2↑+4H+
B.b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
C.理论上每生成1 mol产品,阴极室可生成标准状况下5.6 L气体
D.N室中:a%<b%
【答案】C
【解析】
A.M室中石墨电极为阳极,电解时阳极上水失电子生成O2和H+,电极反应式为2H2O-4e-=O2↑+4H+,A正确;
B.原料室中的B(OH)4-通过b膜进入产品室,M室中氢离子通入a膜进入产品室,则b膜为阴离子交换膜,B正确;
C.理论上每生成1 mol产品,M、N室电极反应式分别为2H2O-4e-=O2↑+4H+、2H2O+2e-=H2↑+2OH-,M室生成1 mol H+、N室生成0.5 mol H2,阴极生成的气体体积在标况下是11.2 L,C错误;
D.N室中石墨为阴极,电解时阴极上水得电子生成H2和OH-,原料室中的Na+通过c膜进入N室,使阴极区溶液中c(NaOH)增大,所以N室:a%<b%,D正确;
故合理选项是C。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次从左至右发生的反应类型和反应条件都正确的是 ( )
选项 | 反应类型 | 反应条件 |
A | 加成反应;取代反应;消去反应 | KOH醇溶液 |
B | 消去反应;加成反应;取代反应 | NaOH水溶液 |
C | 氧化反应;取代反应;消去反应 | 加热;KOH醇溶液 |
D | 消去反应;加成反应;水解反应 | NaOH醇溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在给定条件下一定能大量共存的是
A.强酸性溶液中:H+、NO![]() 、SO
、SO![]()
B.pH=12的溶液中:OH-、K+、Cl-、HCO![]()
C.加入铝粉能放出氢气的溶液中一定存在:NH![]() 、NO
、NO![]() 、AlO
、AlO![]() 、SO
、SO![]()
D.25C时pH=7的无色溶液中:Na+、Cl-、SO![]() 、K+
、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,22.4 L Cl2溶于水充分反应转移NA个电子
B. 标准状况下,2.24 L HF与1.6 g CH4分子所含电子数目均为NA
C. 50 g质量分数为46%的乙醇溶液中氢原子总数为6NA
D. 25 ℃时,1 L 2 mol/L NH4Cl溶液和1 L 1 mol/L (NH4)2SO4溶液中所含NH4+的数目均为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)某二价金属离子有9个价电子,价电子的能级为3d。该元素位于周期表中的第四周期、第______族。
(2)在氰酸钾(KOCN)的组成元素中,第一电离能最大的是______(填元素符号、下同)、电负性最小的是______;其中阴离子的空间结构是______,C的杂化方式为______。
(3)乙二胺能与Mg2+离子形成稳定环状离子:[Mg(C2H8N2)2]2+,其结构如图所示:
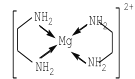
则该环状离子中镁离子的配位数为______。
(4)已知阿伏加德罗常数为NA,立方硫化锌(M=97g/mol)晶胞如图所示:
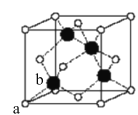
其晶胞棱长为δpm、则其密度为______g/cm3(用含δ的代数式表示);其中顶点位置a的S2-离子与其相邻位置b的Zn2+离子之间的距离为______pm(用含δ的代数式表示)。a位置的S2-离子和b位置的Zn2+离子的分数坐标依次为:______、______。(已知:1m=102cm=1012pm)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,人们对环境保护、新能源开发非常重视。
(1)已知:①CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)ΔH1=-860.0kJmol1
N2(g)+CO2(g)+2H2O(g)ΔH1=-860.0kJmol1
②2NO2(g)![]() N2O4(g)ΔH2=-66.9kJmol1
N2O4(g)ΔH2=-66.9kJmol1
写出CH4催化还原N2O4(g)生成N2、H2O(g)和CO2的热化学方程式_____________。
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH,在t1℃时,反应进行到不同时间测得各物质的物质的量浓度如下:
N2(g)+CO2(g) ΔH,在t1℃时,反应进行到不同时间测得各物质的物质的量浓度如下:
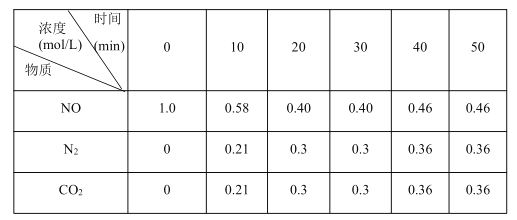
①根据表中数据分析,t1℃时,该反应在0~20min的平均反应速率v(NO)=_____________,该反应的平衡常数K=_____________。
②30min时,只改变某一条件,根据上表中的数据判断改变的条件可能是_____________(填字母代号)。
A.适当缩小容器的体积B.加入合适的催化剂
C.加入一定量的活性炭D.通入一定量的NO
③若30min后升高温度至t2℃,达到平衡时,容器中NO、N2、CO的浓度之比为5∶3∶3,则达到新平衡时NO的转化率_____________(填“升高”或“降低”);ΔH_____________0(填“>”或“<”)。
(3)①已知在一定温度下,反应2NH3(g)+CO2(g)![]() H2NCOONH4(s)ΔH=159.5kJmol1,在2L恒容密闭容器中充入2molNH3和1molCO2,到达平衡时放出127.6kJ的热量,此时,c(NH3)为_____________。
H2NCOONH4(s)ΔH=159.5kJmol1,在2L恒容密闭容器中充入2molNH3和1molCO2,到达平衡时放出127.6kJ的热量,此时,c(NH3)为_____________。
②有一种可充电电池NaAl/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池负极电极反应式为Nae=Na+,则正极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列应用与反应原理设计不一致的是( )
A.热的纯碱溶液清洗油污:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-
+OH-
B.明矾净水:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
C.用TiCl4制备TiO2:TiCl4+(x+2)H2O(过量) ![]() TiO2xH2O↓+4HCl
TiO2xH2O↓+4HCl
D.配制氯化亚锡溶液时加入氢氧化钠:SnCl2+H2O![]() Sn(OH)Cl+HCl
Sn(OH)Cl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示装置的判断,叙述正确的是( )
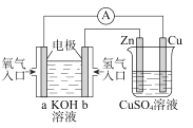
A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.电子流向:Cu→经过CuSO4溶液→Zn→b
D.当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个体积均为2.0L的恒容密闭容器中,反应CO2(g)+C(s)![]() 2CO(g) H>0分别在一定温度下达到化学平衡状态。下列说法正确的是( )
2CO(g) H>0分别在一定温度下达到化学平衡状态。下列说法正确的是( )
容器 | 温度/K | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(CO2) | n(C) | n(CO) | n(CO) | ||
Ⅰ | 977 | 0.28 | 0.56 | 0 | 0.4 |
Ⅱ | 977 | 0.56 | 0.56 | 0 | x |
Ⅲ | 1250 | 0 | 0 | 0.56 | y |
A.达到平衡时,向容器Ⅰ中增加C(s)的量,平衡正向移动
B.x=0.8,y>0.4
C.达到平衡时,容器Ⅲ中的CO的转化率小于![]()
D.若起始时向容器Ⅱ中充入0.1molCO2、0.2molCO和足量的C(s),则反应将向正反应方向进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com