
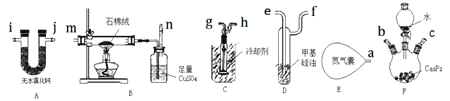
【题目】磷化氢![]() 是一种有大蒜气味的、无色剧毒的强还原性气体,易在空气中自燃,一般在稀释状态下使用能降低风险。某科研小组拟用水解法制备并冷凝收集部分干燥的
是一种有大蒜气味的、无色剧毒的强还原性气体,易在空气中自燃,一般在稀释状态下使用能降低风险。某科研小组拟用水解法制备并冷凝收集部分干燥的![]() ,再利用未液化的余气继续探究其热分解情况。实验装置图及编号如下
,再利用未液化的余气继续探究其热分解情况。实验装置图及编号如下![]() 导管和部分夹持装置省略
导管和部分夹持装置省略![]() ,其中装置D是鼓泡器,用于监测
,其中装置D是鼓泡器,用于监测![]() 的流速。
的流速。
(1)写出![]() 水解法制备
水解法制备![]() 的化学反应方程式________。由于
的化学反应方程式________。由于![]() 水解反应太剧烈,为了减缓反应速率实验室可用________代替水。
水解反应太剧烈,为了减缓反应速率实验室可用________代替水。
(2)实验装置接口的正确连接顺序为![]() ________
________![]() 。
。
(3)![]() 中盛装石棉绒的仪器名称是________;装置E中装有足量的
中盛装石棉绒的仪器名称是________;装置E中装有足量的![]() ,实验中需持续通入后续装置,其作用主要有________
,实验中需持续通入后续装置,其作用主要有________![]() 答两点即可
答两点即可![]() 。
。
(4)![]() 中反应一段时间后,出现白色蜡状固体,经检验为白磷
中反应一段时间后,出现白色蜡状固体,经检验为白磷![]() 。写出该反应的化学方程式________。
。写出该反应的化学方程式________。
(5)在![]() 溶液吸收未反应的
溶液吸收未反应的![]() 气体过程中,产生
气体过程中,产生![]() 和两种常见的最高价含氧酸,反应化学方程式为________;已知
和两种常见的最高价含氧酸,反应化学方程式为________;已知![]() 足量时,
足量时,![]() 可继续被还原生成Cu单质。该小组为了测定此次制备
可继续被还原生成Cu单质。该小组为了测定此次制备![]() 的体积分数,收集到A装置出口的气体体积为
的体积分数,收集到A装置出口的气体体积为![]() 已折算为标准状况
已折算为标准状况![]() ,刚好被
,刚好被![]() 的
的![]() 溶液完全吸收,经过滤、洗涤、干燥后,得到
溶液完全吸收,经过滤、洗涤、干燥后,得到![]() 单质,则
单质,则![]() 的体积分数为________。
的体积分数为________。
【答案】![]() 饱和NaCl溶液
饱和NaCl溶液![]() 或饱和
或饱和![]() 溶液
溶液![]()
![]() 或
或![]() 硬质玻璃管
硬质玻璃管 ![]() 排净装置内的空气,防止自燃
排净装置内的空气,防止自燃 ![]() 稀释生成的
稀释生成的![]() ,降低风险
,降低风险 ![]() 使
使![]() 全部被吸收;
全部被吸收; ![]()
![]()
![]()
【解析】
(1)![]() 属于弱酸强碱盐,溶于水显碱性,水解生成
属于弱酸强碱盐,溶于水显碱性,水解生成![]() 和
和![]() ,化学反应方程式为:
,化学反应方程式为:![]()
![]() ,与水反应速率太快,可以用饱和NaCl溶液
,与水反应速率太快,可以用饱和NaCl溶液![]() 或饱和
或饱和![]() 溶液
溶液![]() 代替水;
代替水;
(2)控制氮气的流速,利用氮气将产生的![]() 带入装置C冷却液化,然后将未冷却的
带入装置C冷却液化,然后将未冷却的![]() 干燥后进行加热分解,最后利用硫酸铜溶液吸收多余的
干燥后进行加热分解,最后利用硫酸铜溶液吸收多余的![]() ,选择连接装置;
,选择连接装置;
(3)![]() 中盛装石棉绒的仪器名称是硬质玻璃管;装置E中装有足量的
中盛装石棉绒的仪器名称是硬质玻璃管;装置E中装有足量的![]() ,实验中需持续通入后续装置,其作用主要有:
,实验中需持续通入后续装置,其作用主要有:![]() 排净装置内的空气,防止自燃
排净装置内的空气,防止自燃 ![]() 稀释生成的
稀释生成的![]() ,降低风险
,降低风险 ![]() 使
使![]() 全部被吸收等;
全部被吸收等;
(4)![]() 中
中![]() 分解生成白磷
分解生成白磷![]() ,根据元素守恒可知另一种产物是氢气;
,根据元素守恒可知另一种产物是氢气;
(5)在![]() 溶液吸收未反应的
溶液吸收未反应的![]() 气体过程中,产生
气体过程中,产生![]() ,两种常见的最高价含氧酸分别为
,两种常见的最高价含氧酸分别为![]() 、
、![]() ;收集到A装置出口的气体体积为
;收集到A装置出口的气体体积为![]() ;
;![]() 与过量
与过量![]() 反应的化学方程式为:
反应的化学方程式为:![]() ,利用铜的质量求出一部分PH3的物质的量,PH3~~~4Cu,PH3与硫酸铜反应
,利用铜的质量求出一部分PH3的物质的量,PH3~~~4Cu,PH3与硫酸铜反应![]() 用硫酸铜总的物质的量减去生成铜的硫酸铜的物质的量
用硫酸铜总的物质的量减去生成铜的硫酸铜的物质的量![]() ,另一部分PH3的物质的量用生成
,另一部分PH3的物质的量用生成![]() 的物质的量计算,8CuSO4~~~PH3,算出两步PH3的总的物质的量,换成标况下的体积,除以气体的总体积可以得到气体的体积分数。
的物质的量计算,8CuSO4~~~PH3,算出两步PH3的总的物质的量,换成标况下的体积,除以气体的总体积可以得到气体的体积分数。
![]() 水解生成
水解生成![]() 和
和![]() ,化学反应方程式为:
,化学反应方程式为:![]()
![]() ;为了减缓反应速率实验室可用饱和NaCl溶液
;为了减缓反应速率实验室可用饱和NaCl溶液![]() 或饱和
或饱和![]() 溶液
溶液![]() 代替水;
代替水;
![]() 控制氮气的流速,利用氮气将产生的
控制氮气的流速,利用氮气将产生的![]() 带入装置C冷却液化,然后将未冷却的
带入装置C冷却液化,然后将未冷却的![]() 干燥后进行加热分解,最后利用硫酸铜溶液吸收多余的
干燥后进行加热分解,最后利用硫酸铜溶液吸收多余的![]() ,所以连接顺序为:
,所以连接顺序为:![]() 或
或![]() ;
;
![]() 中盛装石棉绒的仪器名称是硬质玻璃管;装置E中装有足量的
中盛装石棉绒的仪器名称是硬质玻璃管;装置E中装有足量的![]() ,实验中需持续通入后续装置,其作用主要有:
,实验中需持续通入后续装置,其作用主要有:![]() 排净装置内的空气,防止自燃
排净装置内的空气,防止自燃 ![]() 稀释生成的
稀释生成的![]() ,降低风险
,降低风险 ![]() 使
使![]() 全部被吸收等;
全部被吸收等;
![]() 中
中![]() 分解生成白磷
分解生成白磷![]() ,根据元素守恒可知另一种产物是氢气,反应的化学方程式为:
,根据元素守恒可知另一种产物是氢气,反应的化学方程式为:![]() ;
;
![]() 在
在![]() 溶液吸收未反应的
溶液吸收未反应的![]() 气体过程中,产生
气体过程中,产生![]() ,两种常见的最高价含氧酸分别为
,两种常见的最高价含氧酸分别为![]() 、
、![]() ,反应化学方程式为:
,反应化学方程式为:![]() ;
;![]() 与过量
与过量![]() 反应的化学方程式为:
反应的化学方程式为:![]() ,设生成640mgCu需要
,设生成640mgCu需要![]() 的物质的量为x,则
的物质的量为x,则
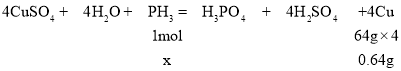
![]() ,解得
,解得![]() ;
;
生成![]() 的
的![]() 物质的量为
物质的量为![]() ,设生成
,设生成![]() 需要
需要![]() 的物质的量为y,则
的物质的量为y,则
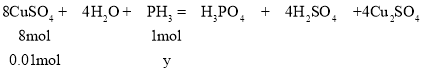
![]() 解得
解得![]()
所以![]() 的体积分数为:
的体积分数为:![]() ;
;
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 加入二氧化锰可使单位时间内过氧化氢分解产生氧气的量增多
B. 工业生产硫酸,通入过量的空气,提高二氧化硫的转化率
C. 久置氯水pH变小
D. Fe(SCN)3溶液中加入KSCN后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒容密闭容器中进行下列两个可逆反应:(甲)C(s)+H2O(g)![]() CO(g)+H2(g);(乙)CO(g)+H2O(g)
CO(g)+H2(g);(乙)CO(g)+H2O(g)![]() CO2(g)+H2(g)。现有下列状态:①混合气体的平均相对分子质量不再改变 ②恒温时,气体的压强不再改变 ③各气体组分浓度相等 ④混合气体的密度保持不变 ⑤单位时间内,消耗水蒸气的质量与生成氢气的质量比为9:1⑥同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明(甲)、(乙)容器中反应都达到平衡状态的是
CO2(g)+H2(g)。现有下列状态:①混合气体的平均相对分子质量不再改变 ②恒温时,气体的压强不再改变 ③各气体组分浓度相等 ④混合气体的密度保持不变 ⑤单位时间内,消耗水蒸气的质量与生成氢气的质量比为9:1⑥同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明(甲)、(乙)容器中反应都达到平衡状态的是
A. ①②⑤B. ③④⑥C. ①⑥D. ⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A.![]() 中含有的
中含有的![]() 键数目为
键数目为![]()
B.标况下![]() 的
的![]() 分子,含共用电子对数
分子,含共用电子对数![]()
C.![]() 分别与足量的
分别与足量的![]() 和
和![]() 充分反应后转移的电子数均为
充分反应后转移的电子数均为![]()
D.![]() 的盐酸与氨水混合后溶液呈中性,则
的盐酸与氨水混合后溶液呈中性,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。
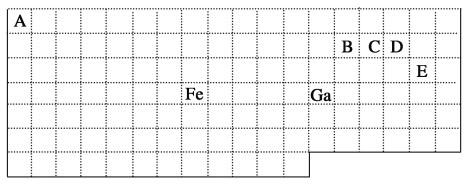
根据信息回答下列问题:
(1)周期表中基态Ga原子的最外层电子排布式为___________。
(2)Fe元素位于周期表的________分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为_______。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有________。
(4)根据VSEPR理论预测ED4-的空间构型为________。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的分子式为_________(写2种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇能发生如下反应:
①![]() ;
;
②![]() ,
,![]() 。
。
由以上反应得出的结论错误的是( )
A.由反应①②可知,条件不同,乙醇与![]() 反应的产物不同
反应的产物不同
B.由反应②可知,![]() 是乙醇氧化生成乙醛的催化剂
是乙醇氧化生成乙醛的催化剂
C.由反应①可知,乙醇燃烧时,碳碳键、碳氢键、碳氧键 、氢氧键均断裂
D.由反应②可知,乙醇氧化为乙醛时,只断开氢氧键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,相同浓度的两种一元酸HX、HY分别用同一浓度的NaOH标准溶液滴定,滴定曲线如图所示。下列说法正确的是![]()
![]()
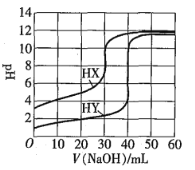
A.HX、HY起始溶液体积相同
B.均可用甲基橙作滴定指示剂
C.pH相同的两种酸溶液中:![]()
D.同浓度KX与HX的混合溶液中,粒子浓度间存在关系式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种短周期元素的原子半径及主要化合价如下表:
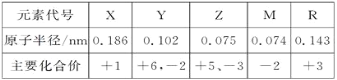
已知X是短周期中最活泼的金属,且与R同周期。下列叙述不正确的是( )
A.离子半径大小:R3+<X+<M2-
B.Y与M组成的化合物是形成光化学烟雾的原因之一
C.将YM2通入Ba(NO3)2溶液中有大量白色沉淀产生
D.M的氢化物的熔、沸点高于Z的氢化物的熔、沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸二甲酯可用作制备维生素B13的中间体,也可用作增塑剂。实验室以草酸![]() 和甲醇为原料制备草酸二甲酯的一种方法如下:
和甲醇为原料制备草酸二甲酯的一种方法如下:![]()
![]()
![]() 。
。
相关物质的有关数据如下表所示:
物质 | 苯 | 甲醇 | 草酸二甲酯 |
熔点/℃ | 5.5 | -97 | 54 |
沸点/℃ | 80.1 | 64.3 | 163.5 |
相对分子质量 | 78 | 32 | 118 |
水溶性 | 不溶 | 互溶 | 不溶 |
实验过程:向如图反应装置中加入27g草酸、40g无水甲醇、100ml苯、5ml浓硫酸,搅拌下加热回流;待反应完全后,分离出甲醇和苯,所得反应液经水洗,有机层再用10%的碳酸钠溶液洗涤,然后用蒸馏水洗涤,加无水氯化钙固体干燥;过滤,滤液冷却后析出晶体,干燥,得草酸二甲酯30.1g。
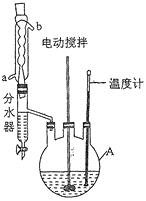
回答下列问题:
(1)仪器A的名称为____________,反应过程中冷却水应从________(填“a”或“b”)口进入。
(2)分离出甲醇和苯的操作名称为______________________________。
(3)用10%的碳酸钠溶液洗涤的目的是____________________________________。
(4)甲醇过量的目的是________________________________________________,浓硫酸的作用是_____________________________________________。
(5)分水器的优点是__________________________________________(任写一点)。
(6)本实验的产率是___________(保留三位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com