
【题目】汽车尾气的主要成分有CO、SO2、NO、NO2等。
(1)利用氨水可以将SO2、NO2吸收,原理如下图所示。
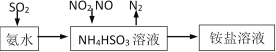
请写出NO2被吸收反应的离子方程式___________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:反应Ⅰ:2NO(g)+O2(g)==2NO2(g) ΔH1 =—113.0 kJ·molˉ1
反应Ⅱ:2SO2(g)+O2(g)==2SO3(1) ΔH2 =—288.4 kJ·molˉ1
反应Ⅲ:3NO2(g)+H2O(g)==2HNO3+NO(g) ΔH3 =—138.0 kJ·molˉ1
则反应NO2(g)+SO2(g)==NO(g)+SO3(1) ΔH4= _______________。
②已知TiO2催化尾气降解原理可表示为:2CO(g)+O2(g) ![]() 2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g)
2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g) ![]() 4HNO3(g) ΔH6。
4HNO3(g) ΔH6。
在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图所示。请解释ts后NO降解率下降的可能原因_____________________。

(3)沥青混凝土也可降解CO。如图为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L—1,求此温度下CO降解反应的平衡常数_______________。
②下列关于如图的叙述正确的是_________________
A.降解率由b点到c点随温度的升高而增大,可知CO降解反应的平衡常数Kb<Kc
B.相同温度下β型沥青混凝土中CO降解速率比α型要大
C.d点降解率出现突变的原因可能是温度升高后催化剂失效
③科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“![]() ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式 ____________________。
【答案】 2NO2+4HSO3—== N2+4SO42—+4H+ -87.7 kJ·molˉ1 由反应Ⅰ、Ⅲ可知ΔH6=—615.0 kJ·molˉ1,随着反应的进行,反应体系中温度升高,使平衡2H2O+4NO+3O2![]() 4HNO3向逆反应方向移动
4HNO3向逆反应方向移动  B、C 见右图
B、C 见右图 Ti-4e—+2H2O==TiO2+4H+
Ti-4e—+2H2O==TiO2+4H+
【解析】(1)本题考查离子方程式的书写,根据题中所给信息,NO2转化成N2,HSO3-被氧化成SO42-和H+,利用化合价升降法进行配平,即离子方程式为2NO2+4HSO3-= N2+4SO42-+4H+ ;(2)考查热化学方程式的书写,以及影响化学平衡移动的因素,①根据盖斯定律,得到(II-I)/2,△H4=(-288.4+113)/2kJ·mol-1=-87.7kJ·mol-1;②依据I×3+III×2,得出:△H6=(-113×3-138×2)kJ·mol-1=-615kJ·mol-1,CO燃烧是放热反应,随着反应进行温度升高,使2H2O+4NO+3O2 ![]() 4HNO3向逆反应方向进行,因此NO的降解率下降;(3)考查平衡常数的计算、以及影响化学反应速率的因素,①令起始时CO的浓度为1mol·L-1,则达到平衡时c(CO)=(1-x)mol·L-1,c(O2)=0.01mol·L-1,c(CO2)=xmol·L-1,根据平衡常数的定义,K=c2(CO2)/[c2(CO)×c(O2)]=x2/[(1-x)2×0.01]=
4HNO3向逆反应方向进行,因此NO的降解率下降;(3)考查平衡常数的计算、以及影响化学反应速率的因素,①令起始时CO的浓度为1mol·L-1,则达到平衡时c(CO)=(1-x)mol·L-1,c(O2)=0.01mol·L-1,c(CO2)=xmol·L-1,根据平衡常数的定义,K=c2(CO2)/[c2(CO)×c(O2)]=x2/[(1-x)2×0.01]=  ;②A、化学平衡常数只受温度的影响,CO的燃烧是放热反应,升高温度,平衡向逆反应方向进行,b点温度低于c点温度,因此Kb>Kc,故A错误;B、根据图2,相同温度下β型沥青混凝土中CO降解速率比α型要大,故B正确;C、d点出现突变,CO的降解率降低,可能是温度升高,造成催化剂失效,故C正确;③催化效果好,即加快反应速率,但对化学平衡移动无影响,即图像是
;②A、化学平衡常数只受温度的影响,CO的燃烧是放热反应,升高温度,平衡向逆反应方向进行,b点温度低于c点温度,因此Kb>Kc,故A错误;B、根据图2,相同温度下β型沥青混凝土中CO降解速率比α型要大,故B正确;C、d点出现突变,CO的降解率降低,可能是温度升高,造成催化剂失效,故C正确;③催化效果好,即加快反应速率,但对化学平衡移动无影响,即图像是 ;(4)考查电极反应式的书写,金属钛作阳极,应先失电子,根据电解目的,阳极反应式为Ti-4e-+2H2OTiO2+4H+。
;(4)考查电极反应式的书写,金属钛作阳极,应先失电子,根据电解目的,阳极反应式为Ti-4e-+2H2OTiO2+4H+。


科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | 溶液中的H+向c极移动 | d极溶解 c极有气体产生 | 电流从a极流出 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>a
C.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代“药金”的冶炼方法是:将炉甘石(ZnCO3)和赤铜矿(Cu2O)与木炭按一定的比例混合后加热至800℃,即可炼出闪烁似金子般光泽的“药金”。下列叙述正确的是( )
A. “药金”实质上是铜锌合金
B. 冶炼炉中炉甘石直接被木炭还原为锌
C. 用王水可区别黄金和“药金”
D. 用火焰灼烧不能区别黄金和药金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试从化学键的角度理解化学反应中的能量变化。(以2H2+O2===2H2O为例说明),已知:E反表示反应物(2H2+O2)所具有的总能量,E生表示生成物(2H2O)所具有的总能量。又知:拆开1moL H2中的化学键需要吸收436kJ能量,拆开1moL O2中的化学键需要吸收496kJ能量,形成水分子中的1moLH—O键能够释放463KJ能量。
⑴从宏观角度看:反应物所具有的总能量高于生成物所具有的总能量,所以该反应要______(填“吸收”或“放出”)能量,能量变化值的大小△E=_________(用E反和E生表示)
⑵从微观角度看:断裂反应物中的化学键吸收的总能量为E吸=______KJ;形成生成物中的化学键放出的总能量为=______KJ。E吸______E放(填“>”或“<”),所以该反应要_____(填“吸收”或“放出”)能量,能量变化值的大小△E=____ KJ(填数值)
⑶由图可知,化学反应的本质是________________________________化学反应中能量变化的主要原因是________________(从总能量说明)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A.CH2=CHCOOH和CH2=CH(CH2 )4 COOH B.12C60和石墨 C.![]() 和
和![]() D.35Cl和37Cl E.乙醇和乙二醇
D.35Cl和37Cl E.乙醇和乙二醇
(1)互为同位素的是________;
(2)互为同系物的是________;
(3)互为同素异形体的是________;
(4)互为同分异构体的是________;
(5)既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,抽去如图所示装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度。下列说法正确的是

A. 反应后瓶内压强是反应前的![]() B. 装置中氢元素的总质量为0.42 g
B. 装置中氢元素的总质量为0.42 g
C. 生成物的分子数目为0.1NAD. 反应结束后,两个集气瓶很容易分开
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.某盐溶液呈酸性,该盐不可能是弱酸与弱碱反应生成的盐
B.向氨水中不断通入CO2气体,溶液中c(OH-)/c(NH3·H2O)相应减小
C.CH3Cl(g)+Cl2(g) ![]() CH2Cl2(l)+HCl(g);常温下能自发进行,则该反应的△H>0
CH2Cl2(l)+HCl(g);常温下能自发进行,则该反应的△H>0
D.硫酸工业中的反成,2SO2(g)+O2(g)![]() 2SO3(g)△H<0,采用500℃左右的高温主要是为了加快反应速率。
2SO3(g)△H<0,采用500℃左右的高温主要是为了加快反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或现象不能用平衡移动原理解释的是
A. 卤化银沉淀的转化

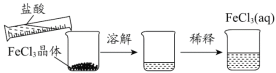
B. 配制FeCl3溶液
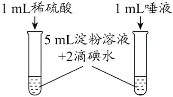
C. 淀粉在不同条件下水解
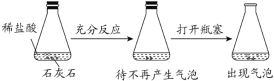
D. 探究石灰石与稀盐酸在密闭环境下的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)丙烷(C3H8)是一种价格低廉的常用燃料,其主要成分是碳和氢两种元素,燃烧后只有二氧化碳和气态水,不会对环境造成污染。已知1 g丙烷完全燃烧放出50.45kJ的热量。丙烷在室温下燃烧的热化学方程式为____。
(2)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
则2CH4(g)+ O2(g)=2CO(g)+4H2(g)ΔH=___;
(3)在密闭容器中充入A(g)和B(g),它们的初始浓度均为2mol·L-1,在一定条件下发生反应:A(g)+B(g)![]() 2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
①该反应的平衡常数的表达式为____。
②A的转化率为_____。
③若升温至T2时,此反应的平衡常数为1,判断该反应ΔH___0(填“>”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com