
【题目】一种以黄铜矿和硫磺为原料制取钢和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
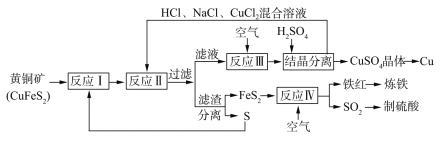
已知:“反应Ⅱ”的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S
回答下列问题:
(1)铁红的化学式为________;
(2)“反应Ⅱ”的还原剂是________(填化学式);
(3)除CuS外“反应II”的产物还有_________(填化学式);
(4)“反应Ⅲ”的离子方程式为_________;
(5)某同学设想利用电化学原理实现以CuSO4、SO2为原料制备Cu和H2SO4,并吸收炼铁过程中产生的CO尾气,实现资源与能源的综合利用。该同学据此组装出的装置如下图所示:

闭合该装置中的K,A池中通入SO2的Pt电极的电极反应式为__________,B池中生成的气体X的电子式为________,若在C池中生成64gCu,则整个装置中共生成H2SO4_____mol。
【答案】 Fe2O3 CuS FeS2 4[CuCl2]-+O2+4H+=4Cu2++8Cl-+2H2O SO2+2H2O-2e-=SO42-+4H+ ![]() 2
2
【解析】(1)铁红的化学式为Fe2O3;(2)“反应Ⅱ”的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S,CuS中硫的化合价升高,“反应Ⅱ”的还原剂是CuS;(3)由流程可知,黄铁矿分解生成的Fe、Cu均为+2价,则反应I的产物为FeS2、CuS;(4)反应Ⅲ中生成铜离子,则离子反应为4CuCl2-+O2+4H+═4Cu2++8Cl-+2H2O;(5)A池是原电池,SO2为负极,A池中通入SO2的Pt电极的电极反应式为SO2+2H2O-2e-=SO42-+4H+ ; B池原电池,CO为负极,氧化产物为CO2,B池中生成的气体X的电子式为![]() ;C中发生2CuSO4+2H2O
;C中发生2CuSO4+2H2O![]() 2Cu+O2+2H2SO4,64gCu反应,生成1molH2SO4,A中原电池也失去2mol电子,生成1molH2SO4,若在C池中生成64gCu,则整个装置中共生成H2SO42mol。
2Cu+O2+2H2SO4,64gCu反应,生成1molH2SO4,A中原电池也失去2mol电子,生成1molH2SO4,若在C池中生成64gCu,则整个装置中共生成H2SO42mol。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)P点表示在t1℃两物质的溶解度关系为bc(填“>”、“<”或“=”).
(2)t2℃,a、b、c三种物质的饱和溶液溶质质量分数的大小关系为 .
(3)t2℃时,50g b物质加入到50g水中充分溶解后,所得溶液的质量为 .
(4)b中含有少量的a,若要提纯b,可采用结晶的方法.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g) + Y(g)![]() M(g) +N(g),所得实验数据如下表所示:
M(g) +N(g),所得实验数据如下表所示:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是
A. 实验①中,若5 min时测得n(M)=0.050 mol,则05 min内,用N表示的平均反应速率v(N) =1.0×10-2 mol/(L min)
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,反应达到平衡时,X的转化率为40%
D. 实验④中,反应达到平衡时,b<0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化钡样品23.1g中含有少量的氯化钠,某同学进行了如图所示的实验.请计算:
①过滤后得到沉淀多少克?
②原样品中氯化钡的质量分数?(计算结果精确到0.1%)
③求D烧杯中所得溶液的溶质质量分数是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国宣布到2030年非化石能源占一次能源消费比重将提高到20%左右。下列不属于化石能源的是
A. 煤 B. 生物质能 C. 天然气 D. 石油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3、N2H4在工业生产和国防建设中都有广泛应用。回答下列问题:
(1)①N2H4(g) ![]() N2(g)+2H2(g) △H1
N2(g)+2H2(g) △H1
②N2(g)+3H2(g) ![]() 2NH3(g) △H2
2NH3(g) △H2
③7N2H4(g) ![]() 8NH3(g)+3N2(g)+2H2(g) △H3
8NH3(g)+3N2(g)+2H2(g) △H3
△H3=___________(用含△H1和△H2的代数式表示),反应③的平衡行数表达式为K=___________。
(2)纳米钴的催化作用下,N2H4可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。当反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图所示。

该反应的△H_____________(填“>”或“<”)0,N2H4发生分解反应的化学方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com