
根据反应2KMnO4+10FeSO4+8H2SO4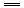 2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,可用作与酸碱中和滴定相同的仪器和操作方法测定绿矾中FeSO4的质量分数.
2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,可用作与酸碱中和滴定相同的仪器和操作方法测定绿矾中FeSO4的质量分数.
实验步骤顺序如下:
①称取绿矾样品W g,配成100mL溶液.
②取25.0mL待测液,置于锥形瓶中,再加入适量H2SO4溶液供滴定使用.
③将m mol/L的标准KMnO4溶液装入滴定液,调节液面刻度至a mL处.
④用标准KMnO4溶液滴定待测液.
⑤该实验是用反应物自身颜色变化指示反应终点,到滴定终点时,滴定管内液面的高度为b mL.
⑥重复滴定操作2~3次.
⑦计算.
请根据以上实验步骤填写有关内容.
(1)实验步骤①中,应从下列仪器中选取的仪器是________.
A.托盘天平(含砝码、镊子)
B.50mL酸式滴定管
C.100mL量筒
D.100mL容量瓶
E.烧杯
F.胶头滴管
G.锥形瓶
H.玻璃棒
L.V形纸槽
J.药匙
(2)不能用________式滴定管盛放KMnO4溶液,其原因是________.
(3)锥形瓶用蒸馏水洗净的标志是________;若锥形瓶未干燥,对实验结果的影响是:________(填“偏高”、“偏低”、“无影响”).
(4)滴定时,两眼应注视________.
(5)绿矾中FeSO4的质量分数为(FeSO4%)________.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:058
①称量样品3.0g,配成100mL溶液
②取20.00mL待测液,置于锥形瓶中,
再加入适量硫酸 ③将0.1mol·L-1的标准 KMnO4溶液装入滴定管,调节液面至amL处(如图)④滴定待测液至滴定终点时,滴定管液面读数为6mL ⑤重复滴定2~3次⑥计算

回答下列问题:
(1)实验步骤③中a的值为________。
(2)实验步骤①、②、③中还需使用的最主要的仪器分别为(填仪器的名称及规格)________。
(3)若滴定时每次消耗KMnO4溶液体积的平均值为VmL,则绿矾样品的纯度为________。(列出算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:058
欲采用滴定的方法测定绿矾中FeSO4的质量分数(约45%),根据反应2KMnO4+10FeSO4+8H2SO4══2MnSO4+5Fe2(SO4)3+K2SO4+8H2O,步骤如下:
①称量样品3.0g,配成100mL溶液
②取20.00mL待测液,置于锥形瓶中,
再加入适量硫酸 ③将0.1mol·L-1的标准 KMnO4溶液装入滴定管,调节液面至amL处(如图)④滴定待测液至滴定终点时,滴定管液面读数为6mL ⑤重复滴定2~3次⑥计算

回答下列问题:
(1)实验步骤③中a的值为________。
(2)实验步骤①、②、③中还需使用的最主要的仪器分别为(填仪器的名称及规格)________。
(3)若滴定时每次消耗KMnO4溶液体积的平均值为VmL,则绿矾样品的纯度为________。(列出算式即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com