
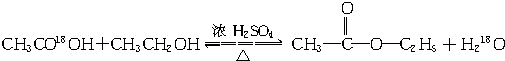 .
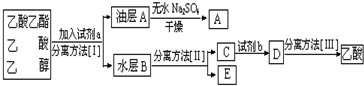
.
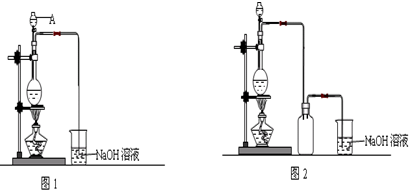
分析 (1)对于液体加热蒸馏,应加入碎瓷片,防止暴沸,实验室合成乙酸乙酯的实验中浓硫酸作催化剂和吸水剂;
(2)乙酸与乙醇的酯化反应是可逆反应,反应中通常加入过量的乙醇,提高乙酸的转化率;
(3)根据合成乙酸乙酯的酯化反应中酸脱羟基、醇脱氢的方法书写化学方程式;
(4)合成乙酸乙酯的酯化反应是可逆反应,根据影响平衡移动的因素可知,及时地蒸出生成物,有利于反应向生成物的方向进行;
(5)粗产品乙酸乙酯中含有乙酸与乙醇,用饱和的碳酸钠溶液反应掉乙酸,溶解乙醇,同时降低乙酸乙酯的溶解度,便于溶液分层,乙酸乙酯密度比水小,乙酸乙酯在上层,然后利用分液,乙酸乙酯加入无水碳酸钠吸收其中的水,可得乙酸乙酯;溶液中含有乙醇、碳酸钠、乙酸钠,进行蒸馏可以收集乙醇,向蒸出乙醇后得到的溶液中加入硫酸,可以得到乙酸,再进行蒸馏可以收集乙酸.
解答 解:(1)对于液体加热蒸馏,应加入碎瓷片,防止暴沸,实验室合成乙酸乙酯的实验中浓硫酸作催化剂和吸水剂,
故答案为:防止暴沸;催化剂和吸水剂;
(2)乙酸与乙醇的酯化反应是可逆反应,反应中通常加入过量的乙醇,提高乙酸的转化率;
故答案为:提高乙酸的转化率;
(3)根据酯化反应的原理可知,合成乙酸乙酯的酯化反应中酸脱羟基、醇脱氢,所以反应的化学方程式为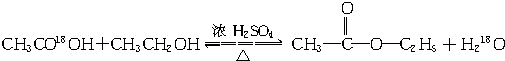 ,
,
故答案为: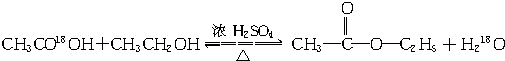 ;
;
(4)合成乙酸乙酯的酯化反应是可逆反应,根据影响平衡移动的因素可知,及时地蒸出生成物,有利于酯化反应向生成酯的方向进行,
故答案为:及时地蒸出生成物,有利于酯化反应向生成酯的方向进行;
(5)粗产品乙酸乙酯中含有乙酸与乙醇,用饱和的碳酸钠溶液反应掉乙酸,溶解乙醇,同时降低乙酸乙酯的溶解度,便于溶液分层,乙酸乙酯密度比水小,乙酸乙酯在上层,然后利用分液,乙酸乙酯加入无水碳酸钠吸收其中的水,可得乙酸乙酯;溶液中含有乙醇、碳酸钠、乙酸钠,进行蒸馏可以收集乙醇,向蒸出乙醇后得到的溶液中加入硫酸,可以得到乙酸,再进行蒸馏可以收集乙酸,
故答案为:饱和的碳酸钠溶液;分液;硫酸;蒸馏.
点评 本题考查乙酸乙酯的制备,难度不大,注意实验混合液的配制、饱和碳酸钠溶液的作用以及酯化反应的机理,(5)中试剂b选择,由于盐酸易挥发,不能使用盐酸.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023个碳-12原子就是阿伏加德罗常数 | |
| B. | 1mol氧含6.02×1023个O2分子 | |
| C. | 1molCaCl2中含3mol离子 | |
| D. | 0.5molCl2含1mol氯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮的固定是指将氮元素由游离态转化为化合态的过程.
氮的固定是指将氮元素由游离态转化为化合态的过程.| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p1${\;}^{2{2}^{3}}$③1s22s22p2④1s22s22p63s23p4 原子半径最大的是① | |
| B. | 具有下列价电子排布式的原子中,①3s23p1 ②3s23p 2 ③3s23p3 ④33s23p 4第一电离能最大是③ | |
| C. | ①Na、K、Rb ②N、P、Si ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ | |
| D. | 某主族元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703…,当它与氯气反应时生成的阳离子是X3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该硫酸的物质的量浓度为9.2mol/L | |
| B. | 常温下,1mol Cu与足量的该硫酸反应产生2g氢气 | |
| C. | 等质量的水与该硫酸混合所得溶液的物质的量浓度小于9.2mol/L | |
| D. | 配制240mL 4.6mol/L的稀硫酸需取该硫酸60mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com