
| A、H2SO4═2H++SO42- |
| B、NH4NO3═NH4++NO3- |
| C、CaCO3═Ca2++CO32- |
| D、Ba(OH)2═Ba2++OH- |
科目:高中化学 来源: 题型:
| A、1:1 | B、1:3 |
| C、3:2 | D、1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
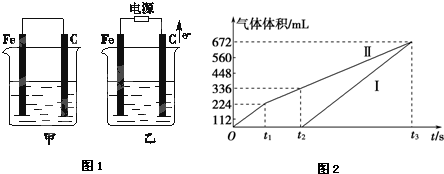
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、Sb元素的质量数是121.8 |
| B、Sb元素的相对原子质量是122 |
| C、Sb原子5p亚层有3个未成对电子 |
| D、Sb原子最外层有5个能量相同的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150mL1mol/LNaCl溶液 |
| B、75mL0.5mol/LCaCl2溶液 |
| C、150mL2mol/LKCl溶液 |
| D、75mL1mol/LAlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
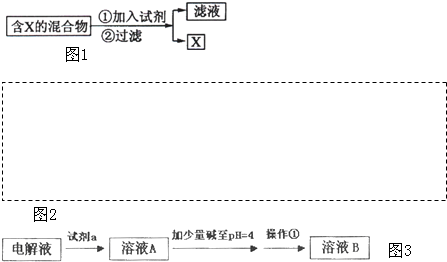
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀 | 3.9. | 9.7 | 6.4 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
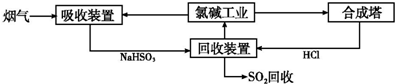
| 分析推测 | 实验步骤及现象 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反 应:Fe3++6SO2?Fe(SO2)63+(反应b) | ⅰ.制备Fe(OH)3胶体并检验 ⅱ.分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe+CuSO4═FeSO4+Cu | ||||
| B、AgNO3+NaCl═AgCl↓+NaNO3 | ||||
C、Fe2O3+3CO
| ||||
D、2KMnO4
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com