
科目: 来源: 题型:
已知反应A2(g)+2B2(g)
 2AB2(g) ΔH<0,下列说法正确的是( )
2AB2(g) ΔH<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目: 来源: 题型:
对可逆反应4NH3(g)+5O2(g)
 4NO(g)+6H2O(g),下列叙述正确的是( ) A.达到化学平衡时,4v正(O2)=5v逆(NO)
4NO(g)+6H2O(g),下列叙述正确的是( ) A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成xmolNO的同时消耗xmolNH3,则反应达到平衡状态
C.化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
查看答案和解析>>
科目: 来源: 题型:
在2L的密闭容器中,发生以下反应:2A(g)+B(g)
 2C(g)+D(g)。
2C(g)+D(g)。
若最初加入的A和B都是4mol,在前10秒钟A的平均反应速率为
0.12mol·L-1·s-1,则10秒钟时,容器中B的物质的量是( )
A.1.6mol B.2.8mol C.2.4mol D.1.2mol
查看答案和解析>>
科目: 来源: 题型:
某温度时,把1molN2O4气体通入体积为10L的真空密闭容器中,立即出现红棕色,反应进行4s时,NO2的浓度为0.04mol·L-1,再经过一定时间后,反应达到平衡,这时容器内的压强为开始时的1.8倍。则正确的是( )
A.前4s以N2O4的浓度变化表示的平均反应速率为0.01mol·L-1·s-1
B.4s时容器内的压强为开始时的1.2倍
C.平衡时容器内含0.4molN2O4
D.平衡时容器内含0.8molNO2
查看答案和解析>>
科目: 来源: 题型:
分子式为C8H10的有机物A与氯气反应生成产物有多种,产物之一B可发生,下列转化合成聚酯类高分子材料,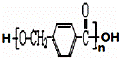
其合成路线如下: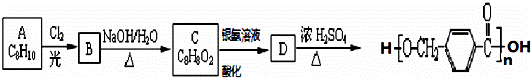
已知:①同一碳原子上连两个羟基时结构不稳定,易脱水生成醛或酮: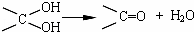
②物质C可发生银镜反应.
请根据以上信息回答下列问题:
(1)B的结构简式为 ,其中的官能团名称为 .
(2)写出下列反应的化学方程式:C与银氨溶液的反应 ,由D生成高分子化合物的反应
(3)C的同分异构体中属于芳香族化合物且能发生水解反应的有6种,其中既能发生水解反应,又能发生银镜反应的有 种.
(4)格氏试剂在有机合成方面用途广泛,可用卤代烃和镁在醚类溶剂中反应制得.设R为烃基,已知:
R﹣X+Mg  R﹣Mg X(格氏试剂);
R﹣Mg X(格氏试剂);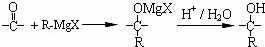
根据以上信息,用C物质和格氏试剂合成另一种高分子化合物 在合成过程中所用的格氏试剂的化学式为 (用X表示卤原子),合成过程中涉及到的有机化学反应类型有 (填编号)
在合成过程中所用的格氏试剂的化学式为 (用X表示卤原子),合成过程中涉及到的有机化学反应类型有 (填编号)
A.加成反应 B.加聚反应 C.氧化反应 D.缩聚反应.
查看答案和解析>>
科目: 来源: 题型:
某同学在实验室从如图I标签的试剂瓶中取少许钠进行燃烧实验,实验后发现还有少许黑色固体生成.从反应物及实验操作猜测:该黑色物质可能为炭与另一种氧化物组成的混合物.
根据题意和图示回答下面问题:
(1)装置图Ⅱ中A的名称
(2)此氧化物可能是FeO或 (写化学式)
(3)对黑色固体物质的组成作如图所示探究
①实验I加入盐酸溶液的目的是 ;
②仅通过实验Ⅱ,用最简步骤能快速确定
黑色氧化物的组成,请完善该设计.(限选试剂:稀盐酸、KSCN溶液、10%H2O2 溶液)
实验操作 预期现象与结论 相关离子方程式
取少量实验Ⅰ中的澄清溶液,加入试剂 . .
.
查看答案和解析>>
科目: 来源: 题型:
现有含CaO杂质的CaC2试样.设计以下实验,测定CaC2试样的纯度.(反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑),请从下图中选用适当的装置,完成该实验.
(1)制取C2H2最好选④中的丙,所选用装置的连接顺序是(填各接口A~E的顺序): .
(2)若实验时称取的试样为1.4g,产生的乙炔在标准状况下的体积为448mL,此试样中CaC2的质量分数为 .(保留3位有效数字)
查看答案和解析>>
科目: 来源: 题型:
氮的化合物是一把双刃剑,它既是一种资源,又会给环境造成危害.
Ⅰ. 氨气是一种重要的化工原料.
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:
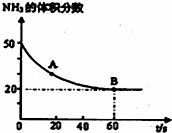
CO2(g)+2NH3(g)⇌(NH2)2CO(s)+H2O(g),在密闭反应容器中,混合气体中NH3的含量变化关系如图所示:则A点的逆反应速率V(逆)(CO2)<B点的正反应速率V(正)(CO2)(填“>”“=”或“<”),氨气的平衡转化率是 .
(2)将一定量的NH2COONH4(s)置于恒温密闭容器中,NH2COONH4(s)⇌2NH3(g)+CO2(g),其分解达到平衡状态时,容器内混合气体的平均相对分子质量为26.该反应的化学平衡常数的表达式为K= .
Ⅱ.氮的氧化物会污染环境.
(3)采取还原法,用炭粉可将氮的氧化物还原.
已知:N2(g)+O2(g)=2NO(g)△H=+180.6kJ•mol﹣1, C(s)+O2(g)=CO2(g)△H=﹣393.5kJ•mol﹣1
写出炭粉还原一氧化氮的热化学反应方程式
(4)若用Na2CO3溶液吸收NO2可生成CO2,9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,则此反应的离子反应方程式为 .若生成的CO2完全逸出,所得溶液中的离子浓度大小关系为 .
查看答案和解析>>
科目: 来源: 题型:
四种短周期元素A、B、C、D的性质或结构信息如下.
①原子半径大小:A>B>C>D
②四种元素之间形成的某三种分子的比例模型及部分性质如下:

请根据上述信息回答下列问题.
(1)C元素在周期表中的位置 ,请写出D2C2分子的结构式 ,A元素的单质与物质甲发生反应的离子方程式 .
(2)丁物质与乙互为同系物,在相同条件下其蒸气的密度是氢气密度的36倍,且核磁共振氢谱只有
1组峰,写出丁物质的结构简式 .
(3)A与同周期的E元素组成的化合物EA5在热水中完全水解生成一种中强酸和一种强酸,该反应的化学方程式是 .
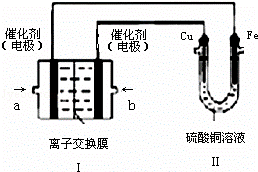
(4)以Pt为电极,KOH为电解质溶液,两极分别通入乙和C的单质可组成燃料电池,该同学想在装置Ⅱ中实现铁上镀铜,则a处电极上发生的电极反应式 ,一段时间后,测得铁增重128g,此时b极通入气体的体积是 L(标准状况下).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com