
科目: 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解质溶液,电池总反应式为:Zn+2MnO2+H2O=Zn(OH)2+Mn2O3。下列说法正确的是( )
A.电池工作时,锌是正极
B.电子由Zn电极通过外电路流向MnO2电极
C. MnO2电极发生氧化反应
D.外电路中每通过0.1 mol电子,锌的质量理论上减小6.5 g
查看答案和解析>>
科目: 来源: 题型:
【题目】用海底锰结核(主要成分为MnO2,含少量MgO、Fe2O3、Al2O3、SiO2)为原料,制备金属锰、镁的一种工艺流程路线如下:
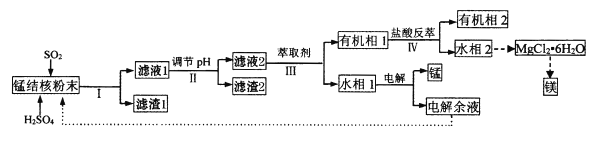
已知:①几种难溶物的溶度积(25℃)如下表所示:
化学式 | Mg(OH)2 | Mn(OH)2 | Al(OH)3 | Fe(OH)3 |
Ksp | 1.8×10-11 | 1.8×10-13 | 1.0×10-33 | 4.0×10-38 |
②溶液中某离子浓度≤1.0×10-6mol·L-1时,认为该离子沉淀完全。
完成下列问题:
(1)“锰结核粉末”中MnO2与SO2反应的离子方程式为_____。
(2)“滤液1”中c(Mn2+)为0.18mol·L-1,则“调节pH”的范围为_______,“滤渣2”的成分为______。
(3)“Ⅲ”处“萃取剂”萃取的成分是___;“Ⅳ”处用“盐酸反萃”的作用是____。
(4)MgCl2·6H2O制取无水MgCl2时,需要在干燥的HCl气流中加热分解。HCl的作用为__________。
(5)该工艺流程中除电解余液可循环利用外,还能循环利用的试剂为____。
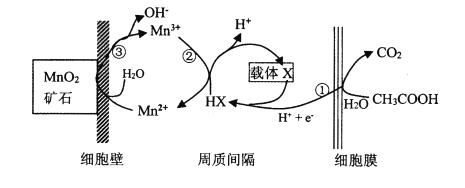
(6)一种海生假单孢菌(采自太平洋深海处),在无氧条件下以醋酸为电子供体还原MnO2生成Mn2+的机理如图所示。写出反应②③的总反应的离子方程式____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A为合成某种抗支气管哮喘药物的中间体,A的结构如下图所示,下列说法正确的是( )
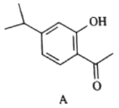
A.每个A分子中含有一个手性碳原子
B.A中所有碳原子可处于同一平面
C.A不能发生氧化反应
D.1molA最多可与4molH2发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)基态Ti原子4s轨道上的一个电子激发到4p轨道上形成激发态,写出该激发态价层电子排布式_____________
(2)锌和镉位于同副族,而锌与铜相邻。现有4种铜、锌元素的相应状态:①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是_________(填字母)。
A.④②①③ B.④②③① C.①②④③ D.①④③②
(3)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
①Cl2O2的沸点比H2O2低,原因是____。
②O3分子的中心原子杂化类型为______;与O3互为等电子体的是______(任意写一种)。
(4)Na3OCl可由以下方法制得:2Na+2NaOH+2NaCl 2Na3OCl+H2↑,在该反应中,形成的化学键有_____(填标号)。
2Na3OCl+H2↑,在该反应中,形成的化学键有_____(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
(5)Na3OCl晶体属于立方晶系,其晶胞结构如图所示。已知:晶胞参数为anm,密度为dg·cm3。
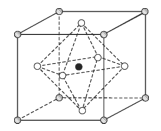
①Na3OCl晶胞中,O位于各顶点位置,Cl位于______位置。
②用a、d表示阿伏加德罗常数的值NA=_____(列计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】 Kx[Cu(C2O4)y]·zH2O (水合草酸铜(Ⅱ)酸钾)是一种化工原料,实验室制备少量水合草酸铜酸钾并测定样品的组成,实验步骤如下:
I制备CuO
用图1所示装置将溶液混合后,小火加热至蓝色沉淀变黑色生成CuO,煮沸5~10分钟。稍冷却后全部转移至图2装置过滤,并用蒸馏水洗涤沉淀2~3次。
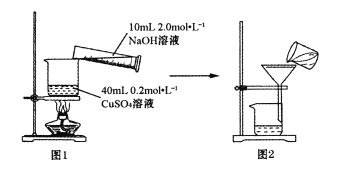
(1)①指出图2装置中操作中的错误___________,图2操作需用蒸馏水洗涤沉淀2~3次,其目为___________。
②检验沉淀洗涤干净的方法为___________。
Ⅱ制备KHC2O4和K2C2O4混合溶液
称取3.0g H2C2O4·2H2O放入250mL烧杯中,加入40mL蒸馏水,微热(温度低于80℃)溶解。稍冷后分数次加入2.2g无水K2CO3,充分反应后生成含KHC2O4和K2C2O4的混合物。
(2)该步骤中所得混合物中n(KHC2O4):n(K2C2O4)=____________。(取整数)
Ⅲ制备水合草酸铜酸钾晶体
将KHC2O4和K2C2O4混合溶液水浴微热,再将CuO连同滤纸一起加入到该溶液中,充分反应至CuO沉淀全部溶解,取出滤纸后,加热浓缩、冷却结晶、过滤,用乙醇淋洗,自然晾干,称量得到样品2.9760g(电子天平称量)。
(3)①步骤Ⅲ中KHC2O4的作用是__________。
②用乙醇淋洗而不用水的优点是__________。
③溶解CuO沉淀时,连同滤纸一起加人到溶液中的目的是__________。
Ⅳ测定水合草酸铜酸钾晶体的成分
取少量制得的样品配成溶液。用标准酸性髙锰酸钾溶液滴定![]() 、用标准EDTA溶液(PAR为指示剂)滴定Cu2+,经计算样品中n(Cu):n(
、用标准EDTA溶液(PAR为指示剂)滴定Cu2+,经计算样品中n(Cu):n(![]() )=1:2,假设制备样品的过程中Cu2+无损耗。
)=1:2,假设制备样品的过程中Cu2+无损耗。
(4)水合草酸铜(Ⅱ)酸钾晶体的化学式为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题给要求填空
(1)某元素的基态原子最外层电子排布式为3s23p2,它的次外层上电子云形状有________种,原子中所有电子占有________个轨道,核外共有________种运动状态不同的电子。
(2)E原子核外占有9个轨道,且具有1个未成对电子,E离子结构示意图是_______。
(3)F、G都是短周期元素,F2-与G3+的电子层结构相同,则G元素的原子序数是________,F2-的电子排布式是______。
(4)M能层上有________个能级,有________个轨道,作为内层最多可容纳________个电子,作为最外层时,最多可含有________个未成对电子。
查看答案和解析>>
科目: 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
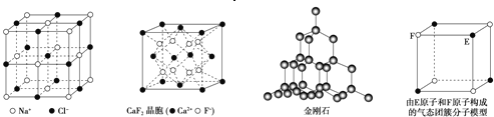
A.在NaCl 晶体中,距Na 最近的Cl 形成正八面体
B.在![]() 晶体中,每个晶胞平均占有4 个Ca2+
晶体中,每个晶胞平均占有4 个Ca2+
C.在金刚石晶体中,碳原子与碳碳键个数的比为1:2
D.该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目: 来源: 题型:
【题目】铁及其化合物在生产生活及科学研究方面应用非常广泛。
(1)基态Fe原子的价层电子的电子排布图为_________________,其最外层电子的电子云形状为___________。
(2)(NH4)2Fe(SO4)26H2O俗称摩尔盐。
①O、S两元素的电负性由大到小的顺序为_____________(用元素符号表示)。
②N、O两元素的的第一电离能由大到小的顺序为___________(用元素符号表示)。
③SO42-中S原子的杂化方式为___________,VSEPR模型名称为___________________。
(3)Fe3+可与某阴离子发生特征的显色反应,用于鉴定Fe3+。该阴离子的电子式为_____,σ键和π键的数目之比为______________。其空间构型为__________。
(4)K3[Fe(CN)6]晶体中配离子的配位体为_____(用化学符号表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,用0.10 mol·L-1NaOH溶液滴定20 mL 0.10 mol·L-1HA溶液,测得混合溶液的pH与lg![]() 的关系如图所示。下列叙述正确的是
的关系如图所示。下列叙述正确的是
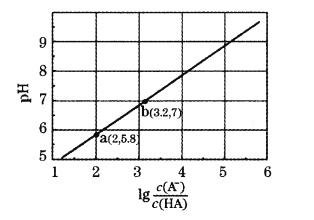
A.HA为弱酸,Ka的数量级为10-3
B.b点时消耗NaOH溶液的体积大于20 mL
C.溶液的导电能力:b>a
D.b点溶液中:c(Na+)=c(Aˉ)=(H+)=c(OHˉ)=10-7mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】我国学者最近研发一种新型铝—石墨烯电池,其负极是金属铝,正极是石墨烯(Cn)薄膜,电解质为阳离子(EMI+)与阴离子(![]() )组成的离子液体,该电池的工作原理如图。已知能量密度是指一定质量物质中储存能量的大小。下列说法错误的是
)组成的离子液体,该电池的工作原理如图。已知能量密度是指一定质量物质中储存能量的大小。下列说法错误的是
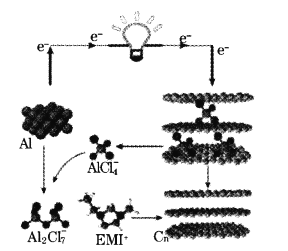
A.该铝电极电池比锂电极电池的能量密度低
B.石墨烯电极的比表面积大,充放电性能优于石墨电极
C.充电时,有机阳离子(EMI+)向铝电极移动
D.放电时,负极的电极反应式为2Al+7Clˉ-6eˉ=Al2Cl![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com