
江苏省江安中学2009届高三年级第三次月考
化学试卷
时 量:90min 满分:108分
可能用到的相对原子质量: H~1 Cl~
I卷 选择题部分(总计48分)
一、选择题(本题包括16个小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.食品检验是保证食品安全的重要措施,下列哪些物质的含量是在食品中是严格控制的
①烧烤食品中苯并芘的含量 ②奶粉中三聚氰胺的含量
www.1010jiajiao.com
③亚硝酸盐的含量 ④苯甲酸钠的含量
A.①②③ B.①③④ C.②③④ D.①②③④
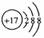 2.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是www.1010jiajiao.com
2.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是www.1010jiajiao.com
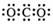 A.CO2的电子式 B. Cl-的结构示意图
A.CO2的电子式 B. Cl-的结构示意图
C.氢有三种同位素: H、
H、 H、
H、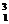 H,故可形成三种分子
H,故可形成三种分子
D.氧气和臭氧、红磷和白磷、普通水和重水互称为同素异形体
3.下列关于热化学反应的描述中正确的是www.1010jiajiao.com
A.需要加热才能发生的反应一定是吸热反应
B.当反应物的总能量比生成物的总能量高时,为放热反应;当生成物的总能量比反应物的能量高时,则表现为吸热反应。
C.CO(g)的燃烧热是283.0 kJ?mol-1,则CO(g)的燃烧热的热化学方程式为:
2CO(g)+O2(g) =2CO2(g);ΔH=-566 kJ?mol-1
D.HCl和NaOH反应的中和热ΔH=-57.3 kJ?mol-1,则1molH2SO4和1molBa(OH)2反应放出的热量为114.6kJ
4.下列有关离子大量共存的说法正确的是
A. S2―、Na+、Fe3+、SO42―能大量共存
B.水电离产生c(H+)=1×10-12mol/L的溶液中,可能有Mg2+、Na+、Cl-、HCO3大量共存
C.澄清透明的溶液中,可能有Ba2+、Cl―、Al3+、SO42-大量共存
 D.在K+、AlO2―、Cl―、SO42- 溶液中加入过量Na2O2后仍能大量共存
D.在K+、AlO2―、Cl―、SO42- 溶液中加入过量Na2O2后仍能大量共存
5.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:
3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+
关于该反应的说法中正确的组合是
① 氧化剂是H3AsO3 ② 还原性:Cl->As;③ 每生成1molAs,反应中转移电子的物质的量为3mol;④ M为OH-;⑤ SnCl62-是氧化产物。
A.①③⑤ B.①②④⑤ C.①②③④ D.只有①③
6.下列有关Na2CO3和NaHCO3性质的比较中,不正确的是
A.对热稳定性:Na2CO3 >NaHCO3 B.常温时水溶性:Na2CO3 >NaHCO3
C.与稀盐酸反应的快慢:Na2CO3 >NaHCO3 D.相对分子质量:Na2CO3>NaHCO3
7.下列叙述中,正确的是
A.含金属元素的离子一定都是阳离子
B.在氧化还原反应中,非金属单质一定是氧化剂
C.金属阳离子被还原不一定得到金属单质
D.某元素从化合态变为游离态时,该元素一定被还原
8.在相同条件下,A容器中的O2和B容器中的NH3所含的原子总数相等,则两个容器的
体积比为
A.1:2
B.1:
9.R、Q为短周期中的两种元素,R元素原子的最外层电子数与次外层电子数之差的绝 对值等于电子层数;Q元素的原子比R元素的原子多2个核外电子,则下列叙述中肯定不正确的是
A.原子半径:R>Q B.R和Q可形成离子化合物
C.R和Q可形成共价化合物RQ2 D.R和Q可形成共价化合物RQ3
10.氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性,下列叙述中不正确的是?
A.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟?
B.钠在氯气中燃烧,生成白色的烟
C.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现白色烟雾。
D.氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸?
11.取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是
A.1:1:2 B.2:1:
12.下列排列顺序正确的是
① 热稳定性:H2O>HF>H2S ② 原子半径:Na>Mg>O
③ 酸性:H3PO4>H2SO4>HClO4 ④ 结合质子能力:OH->CH3COO->Cl-
A.①③ B.②④ C.①④ D.②③
13.用惰性电极实现电解,下列说法正确的是
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
14.某白色固体可能由①NH4Cl②AlCl3③NaCl④AgNO3⑤KOH中的一种或几种组成,将此固体投入水中得到澄清溶液,该溶液可使酚酞呈红色。若向该溶液中加入稀硝酸至过量,有白色沉淀生成。对原固体组成的判断不正确的是
A.可能存在② B.至少有②⑤
C.无法确定是否有③ D.至少存在①④⑤
15.某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使红色石蕊试纸变蓝。由该实验能得到的正确结论是
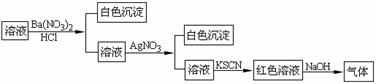
A.原溶液中一定含有SO42-离子 B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl-离子 D.原溶液中一定含有Fe3+离子
16.把一块镁铝合金投入到1mol/L HCl溶液里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如下图A所示。下列说法中不正确的是
A.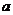 的取值范围为0≤a<50
的取值范围为0≤a<50
B.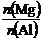 的最大值为2.5
的最大值为2.5
C.若将关系图改为B图时,则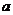 的取值范围为80<a<90
的取值范围为80<a<90
D.若将关系图改为C图时,则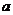 的取值范围为75<a<90
的取值范围为75<a<90
第II卷 非选择题部分(总计60分)
17.(12分)A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个电子。请回答下列问题:
(1)A和B两元素也可以形成18电子的化合物M,则M的电子式为 。
(2)由C和E所形成的化合物中含有的化学键是 ,该化合物属于
晶体(填晶体类型)。
(3)由A、B、C、D四种元素所形成的两种化合物相互之间反应的离子方程式为:
。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1∶1∶1,将该盐溶液
在空气中露置一段时间后(充分光照,不考虑水分的挥发),溶液的pH近似为7,
则该过程的总反应方程式为 。
18.(15分)已知A、B、C是三种常见的固体化合物,焰色反应均显黄色,其中A与C按任意比例混合,溶于足量的水中,得到的溶质也只含有一种,并有无色、无味的气体D放出。另A、B、C、D之间含有如下的转化关系:(部分物质未写出)
 |
(1)写出物质的化学式:
A 、 B 、 C 。
(2)写出A、B按物质的量之比为1:1在密闭容器中加热发生反应的化学方程式:
。
(3)写出溶质E与足量CO2反应的离子方程式: 。
19.(14分)下图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;IV、V、VI是气体收集装置,根据要求回求答下列问题:
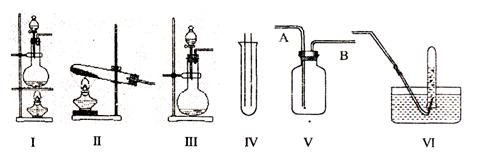
(1)气体发生装置的选择:若用CaCO3与盐酸反应制CO2,则可选择 ;(填序号)
若用NH4Cl和Ca(OH)2反应制NH3,则可选择 ;(填序号)
若用MnO2与浓盐酸反应制取氯气,应选用装置 ,(填序号)
用离子方程式表示制取氯气的反应原理是 。
(2)收集装置的选择:若选用V为氯气收集装置,则氯气应从 口通入。用化学方法检验氯气收集满的方法是 。
(3)气体的吸收:若经试验发现,现1体积的水已吸收336体积的HCl,且得到的溶液的密度为1.08g/cm3,则所得溶液中溶质的物质的量浓度为 mol/L。
 20.(12分)奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是:食品与硫酸和催化剂一同加热消化,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
20.(12分)奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是:食品与硫酸和催化剂一同加热消化,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:
(1)样品处理:准确称取一定量的固体样品奶粉,移入干燥的凯氏烧瓶中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
(2)NH3的蒸馏和吸收:把制得的溶液(取一定量),通过定氮装置,经过一系列的反应,使氨变成硫酸氨,再经过再经过碱化蒸馏后,氨即成为游离状态,游离氨经硼酸吸收。
(3)氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,从消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
试回答下列问题:
(1)在样品的处理过程中使用到了容量瓶,怎样检查容量瓶是否漏水?



。 (2)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大( )
A、凯氏烧瓶中溶液转移移到容量瓶中时,未洗涤凯氏烧瓶
B、定容时,俯视刻度线
C、定容时,仰视刻度线
D、移液时,有少量液体溅出
(3)若称取样品的质量为1.5g,共配制100毫升的溶液,取其中的20mL,经过一系列处理后,使N转变为硼酸铵然后用0.1mol/L盐酸滴定,共用去盐酸的体积为23.0mL,则该样品中N的含量为
。
已知:滴定过程中涉及到的反应方程式:(NH4)2 B4O7
+ 2HCl + 5H2O = 2NH4Cl
+ 4H3BO3
(4)一些不法奶农利用“凯氏定氮法”只检测氮元素的含量而得出蛋白质的含量这个检测法的缺点,以便牛奶检测时蛋白质的含量达标,而往牛奶中添加三聚氰胺(C3N6H6)。则三聚氰胺中氮的含量为
。

21、有一硝酸盐晶体,分子式为M(NO3)x?nH2O,经测定其摩尔质量 
(1)x值是多少?
(2)求M的相对原子质量和n值。
(3)如电解过程中溶液体积不变,计算电解结束后溶液的PH。
选择题答案:
1-5 D/B/B/D/A 6
17、(12分)
(1)H2O2的电子式 (3分) (2)离子键(1分) 离子晶体(2分)
(3)HSO3― + H+ = SO2 + H2O(3分)
(4)2NaClO = 2NaCl + O2 (3分)
18、(共15分,每空3分)
(1)A、NaOH B、NaHCO
(2)NaOH + NaHCO3 = Na2CO3 + H2O
(3)CO32- + CO2 + H2O =2HCO3―
19、(共14分,每空2分)
|