
2008年扬州市初中毕业升学统一考试
化学试卷
注:满分100分,考试时间90分钟。
可能用到的相对原子质量:
H:1 C:12 O:16 Mg:24 S:32 Cl:35.5 Ca:40 Fe:56
第Ⅰ卷(选择题 共40分)
一、选择题(本题包括15小题,每小题2分,共30分,每小题只有一个选项符合题意)
1.
A.海水晒盐 B.太阳能光解水制氢气
C.饮用水生产 D.肥皂水区分硬水和软水
2.下列物质中属于纯净物的是
3.扬州城“双东”老城区的改造,全方位再现了'扬州古城的历史风貌。下面关于旧城改造的做法不合理的是
A.污水集中处理 B.垃圾分类回收 C.推广小型煤炉 D.种植大量花草
4.(亚)铁磁性纳米材料因其特殊的磁学性能,在生物、医药、电子器件等领域具有广泛的应用前景。某磁性纳米材料X的一种制备方法为: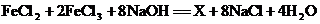 。该磁性纳米材料X的化学式是
。该磁性纳米材料X的化学式是
A.Fe(OH)2 B.Fe(OH)
5.2007年诺贝尔物理奖授予了法国科学家阿尔贝?费尔和德国科学家彼得?格林贝格尔,以表彰他们发现巨磁电阻效应。该成果推动了磁信息材料的发展,MgFe2O4是一种磁信息材料,广泛应用于电子计算机。则MgFe2O4中Fe的化合价为
A.+1 B.+2 C.+3 D.+4
6.下列实验操作正确的是
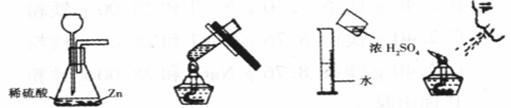
A.制取H2 B.给溶液加热 C.稀释浓硫酸 D.熄灭酒精灯
7.合理利用资源是当今世界所关注的话题。下列做法中不合理的是
A.设计雨水回收系统 B.建风力发电站
C.使用太阳能路灯 D.深埋废弃金属
8.奥运赛场上处处体现了高科技的存在,北京有世界一流的兴奋剂检测中心。乙基雌烯醇是一种常见的兴奋剂,其化学式为C20H32O。下列说法错误的是
A.乙基雌烯醇由C、H、O三种元素组成
B.乙基雌烯醇中C、H、O三种元素原子个数比为20┱32┱1
C.乙基雌烯醇的相对分子质量为288
D.乙基雌烯醇中C、H、O三种元素的质量比为20┱32┱1
9.
A.燃料的选择 B.太阳光线的强弱
C.火种的保存 D.大气中氧气的含量
10.从新买的衣服上取一段线头,在火上灼烧,闻到一股烧焦羽毛的气味。该衣服的面料中含有
A.羊毛 B.麻 C.棉 D.化学纤维
11.“庄稼一枝花,离不开肥当家”。化学肥料与传统农家肥配合使用,对促进农作物增产、解决粮食短缺问题起了重要作用。下列属于复合肥料的是
A.硝酸铵NH4NO3 B.碳酸氢钾KHCO3
C.尿素CO(NH2)2 D.磷酸二氢铵NH4H2PO4
12.人体中缺少某些元素,会影响健康,甚至引起疾病。下列说法正确的是
A.缺铁易患贫血病 B.缺碘易患夜盲症
C.缺锌易患甲状腺疾病 D.缺钙易患动脉硬化疾病
13.下列实验现象的描述正确的是
A.镁带在空气中剧烈燃烧,生成黑色固体
B.将SO2通入紫色KMnO4溶液,溶液变蓝
C.薯片上滴加碘水,薯片变蓝
D.硫酸铜溶液中滴加氢氧化钠溶液,生成红色沉淀
14.现有一杯
A.加入一定量的硝酸钾 B.恒温蒸发部分水
C.升温到
15.今年5月25日,美国“凤凰”号火星探测器成功着陆火星北极。随着各种探测器靠近或登陆火星,人们对火星有了更深的了解。火星大气中95%是二氧化碳,其余为少量的氮气、氢气,还找到了有液态水存在过的证据。根据以上信息,下列推断正确的是
A.火星上钢铁容易生锈 B.火星上一定存在生命
C.火星上温室效应显著 D.火星与地球大气成分相似
二、选择题(本题包括5小题,每小题2分,共10分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给满分,但只要选错一个该小题就为0分)
16.欲除去不纯物质中的杂质(括号内为杂质),所用试剂和方法均正确的是
选项
待提纯物质
选用试剂
操作方法
A
H2(H2O)
浓硫酸
洗气
B
CaO(CaCO3)
盐酸
蒸发、结晶
C
CuSO4溶液(硫酸)
氧化铜
蒸发、洗涤
D
Cu(Fe)
稀硫酸
过滤、洗涤、干燥
17.对实验现象的观察和分析,有助于我们获得化学知识并学会科学探究的方法。下列对实验现象分析正确的是
A.碱性溶液能使酚酞试液变红,所以能使酚酞试液变红的溶液一定呈碱性
B.氧化钙溶于水使水温升高,所以能使水温升高的物质一定是氧化钙
C.碳酸盐与盐酸反应放出气体,所以与盐酸反应放出气体的物质一定是碳酸盐
D.氯化钠能使水的凝固点降低,所以能使水的凝固点降低的物质一定是氯化钠
18.下列分别是一种气体制取、干燥、收集的装置图,该气体可能是
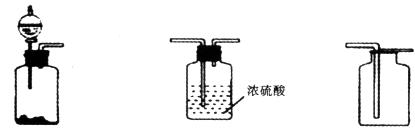
A.O2 B.H2 C.CO2 D.NH3
19.有一Fe与FeO的混合物,测得其中铁元素质量分数为80%。取该混合物
A.
20.向一定量的稀盐酸中加入铁粉,下列示意图正确的是
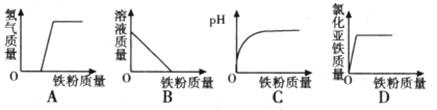
第Ⅱ卷(非选择题 共60分)
三、(本题包括4小题,共17分)
21.(4分)化学就在我们身边,它与我们的生活息息相关,请从A.熟石灰、B.纯碱、C.氧气、D.石灰石、E.纤维素、F.维生素这六种物质中,选择适当的字母序号填空:
(1)用于去除油污的是 ;
(2)能使带火星的木条复燃的是 ;
(3)用作水泥生产原料的是 ;
(4)用于配制农药波尔多液的是 。
22.(8分)写出下列变化的化学方程式,并按要求填写所属反应类型:
(1)实验室用过氧化氢制氧气 属于 反应。
(2)“曾青(CuSO4)得铁化为铜” 属于 反应。
(3)高炉炼铁中,一氧化碳与氧化铁在高温下反应 。
(4)酸雨形成中的亚硫酸(H2SO3)与氧气作用生成硫酸 。
(5)我国发射神舟飞船所用的长征捆绑式火箭,是用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作为液体燃料。偏二甲肼在四氧化二氮中充分燃烧,生成一种空气中含量最多的气体和两种氧化物并放出能量: 。
23.(3分)下图是工业上制备氢气的微观示意图,其中不同的球代表不同种原子。
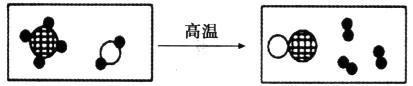
该反应共涉及到 种元素 种分子,其中属于单质的是 (填化学式)。
24.(2分)国务院规定从今年6月1日起,在全国范围内禁止生产、销售、使用厚度小于
四、(本题包括2小题,共17分)
25.(9分)我国的瓷器举世闻名,普通陶瓷中含有铝元素,其元素符号为 ,该元素氧化物的化学式为 (并请标出其中铝元素化合价)。普通玻璃中含有钠元素,含该元素碱的化学式为 ,常温下其溶液pH 7(填“>”、“<”、“=”),若向其溶液中加水,则所得溶液pH (填“升高”、“降低”、“不变”)。陶瓷和玻璃的主要成分都是硅酸盐,它们同属于 材料(填字母)。
A.金属 B.无机非金属 C.合成 D.复合
材料的性质决定用途,从用途上也可找到其所具有的性质。实验室中的许多仪器都是用玻璃或陶瓷制成的。如试管选用普通玻璃,而蒸发皿选用普通陶瓷,请分别说出这样选择的理由 、 。
26.(8分)某化工厂为综合利用生产过程中的副产品CaSO4,与相邻的化肥厂联合设计了以下制备(NH4)2SO4的工艺流程:
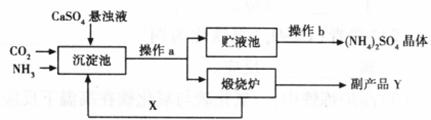
(1)上述流程中,沉淀池中发生的主要化学反应为: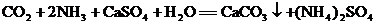 ,煅烧炉中发生的化学反应方程式为 。该工艺中可循环使用的X为 (填化学式,下同),副产品Y为 。
,煅烧炉中发生的化学反应方程式为 。该工艺中可循环使用的X为 (填化学式,下同),副产品Y为 。
(2)操作a的名称是 ,实验室中进行此操作时,用到的玻璃仪器除玻璃棒、烧杯外,还需 ,请说出该仪器的另外一种用途 。操作b的过程是 、冷却、 。
五、(本题包括2小题,共26分)
27.(8分)无焰食品加热器常用于野外加热食物,它的成分是镁粉、铁粉、氯化钠。使用时加入水,镁和水反应产生热量。下面是在
实验1:
Ⅰ、将一定质量的镁条、铁粉和氯化钠加入盛有100 mL水的隔热容器中,连续搅拌,每50 S记录一次温度,得下图中曲线a;
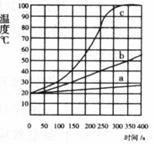
Ⅱ、将相同质量的镁条剪成100份代替Ⅰ中镁条重复以上实验,得上图中曲线b;
Ⅲ、用相同质量的镁粉代替Ⅰ中镁条重复以上实验,得图甲中曲线c。
(1)从能量变化角度看,该变化是由 能转化为 能。
(2)观察上图,从中可以发现影响镁和水反应速率的因素是 。
实验2:
将
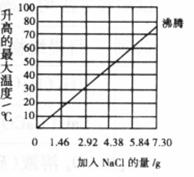
(3)实验2中,当NaCl质量 大于
A.加入更多的NaCl不再增加反应速率
B.加入更多的NaCl会降低反应速率
C.已达到水的沸点,温度不会再有变化
D.需加入更多的铁粉来提高水的温度
(4)如果在实验2中加入质量为
(5)某同学设计了下面四种无焰食品加热器物料配方,请根据本次实验研究的结论,判断其中最合理的是 。
A.
B.
C.
D.
其理由是 。
28.(18分)某校化学小组对热水壶底部水垢的主要成分进行了'如下探究,请完成以下活动并回答相关问题。
【查阅资料】
天然水中含有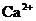 、
、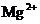 、
、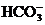 等离子,在加热条件下,这些离子趋于生成溶解度更小的物质――水垢(主要成分为碳酸盐和碱)。有关物质的溶解性见下表:
等离子,在加热条件下,这些离子趋于生成溶解度更小的物质――水垢(主要成分为碳酸盐和碱)。有关物质的溶解性见下表:
部分钙、镁化合物溶解性表(
阴离子
阳离子
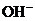
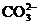
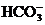
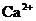
微溶
不溶
可溶
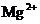
不溶
微溶
可溶
【提出猜想】
水垢的主要成分中一定含有 和 ,可能含有Ca(OH)2和MgCO3(填化学式)。
【设计方案】
实验1:确定水垢中是否含Ca(OH)2和CaCO3。
实验步骤
实验现象
结论
在少量研碎的水垢中,加入适量的蒸馏水充分搅拌,过滤,在滤液里加入Na2CO3溶液
没有白色沉淀产生
_________________________
实验2:确定水垢是否含MgCO3。
利用下列实验装置,完成实验2探究。其主要实验步骤如下:
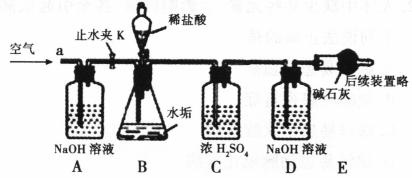
称量D、E装置总质量为
【实验讨论】
(1)加入样品前还应 ,装置B中盛放稀盐酸的仪器名称为 ,装置C的作用是 ,反应结束后打开止水夹K,缓缓鼓入空气的目的是 ,装置A的作用是 。A、B装置之间 设置干燥装置(填“要”、“不要”),其理由是 。
(2)装置B中生成气体的化学反应方程式为 (只要求写一种),装置D中的化学反应方程式为 。
(3)装置B中生成CO2的质量为 g。通过计算说明水垢中 含MgCO3(填字母)。
A.一定 B.一定不 C.可能 D.无法确定
计算过程(已知物质相对分子质量CaCO3:100,MgCO3:84):
实验3:确定水垢中是否含有Mg(OH)2。
另取质量为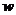 g。结合以上实验结论,判断当
g。结合以上实验结论,判断当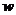 的值满足 条件时,水垢中一定含有Mg(OH)2(请通过计算说明)。
的值满足 条件时,水垢中一定含有Mg(OH)2(请通过计算说明)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com