
2008年福建省宁德市初中毕业、升学考试
化学试卷
(满分100分,考试时间60分钟)
一、本题包括8小题,每小题3分,共24分,每小题只有一个选项符合题意。
1.下列各种食物中蛋白质含量最丰富的是( )

2.化石燃料是不可再生能源,在地球上的蕴藏量是有限的,开发和有效利用新能源迫在眉睫。下列能源中属于新能源的是( )
A.煤 B.石油 C.太阳能 D.天然气
3.下图是一个化肥厂生产的一种化肥包装袋上的部分说明,这种化肥属于( )
尿素[CO(NH2)2]
净含量:
含氮量:≥45.0%
××化肥厂出品
A.磷肥 B.氮肥 C.钾肥 D.复合肥料
4.自今年6月1日起,国家规定所有超市、商场、集贸市场等零售场所实行塑料袋有偿使用制度。对塑料制品的使用及处理下列看法中不正确的是( )
A.少用和重复使用某些塑料制品
B.用化学方法对废弃塑料制品加工成防水涂料或汽油
C.将塑料集中起来焚烧
D.建议使用一些新型的、可降解的塑料,如微生物降解塑料和光降解塑料等
5.下列变化属于化学变化的是( )
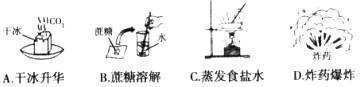
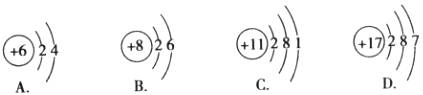
6.下列各原子结构示意图中,表示金属原子的是( )
7.做实验时,如果不慎将酒精灯打翻而着火,最简单的灭火方法是
A.用湿抹布扑灭 B.用水扑灭
C.用手扑灭 D.用泡沫灭火器灭火
8.一定温度下,把
A.它是不饱和溶液
B.它是浓溶液
C.它是该温度下的饱和溶液
D.它的溶质质量分数为1%
二、(本题包括4小题,每小题3分,共12分。先在A、B、C中选择一个正确选项,然后在D处再补充一个符合题意的答案填到横线上。每小题的选择2分,填充1分)
9.下列化学反应属于分解反应的是
A.Ca(OH)2+CO2==CaCO3↓+H2O
B.2CO+O2 2CO2
2CO2
C.2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D._____________________________________
10.下图是铁和硫在氧气中燃烧的两个实验示意图,根据图中所发生的化学反应现象及化学反应原理回答,这两个反应的共同特点有
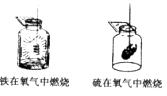
A.反应都生成气体
B.反应都放出热量
C.都能在常温下进行反应
D.______________________________________
11.小红在烧菜时,希望食盐能溶解得快些,下列方法可行的是
A.多放些食用油
B.使用粗粒盐
C.使用精细盐
D.___________________________________
12.比较镁和银的金属活动性强弱,可选用的试剂或方法是
A.稀盐酸
B.氢氧化钠溶液
C.氯化镁溶液
D.__________________________________
三、(本题包括3小题,共26分)
13.(4分)我们日常生活与化学有着密切的联系。请用①CH4 ②NaCl ③C2H5OH ④Ca(OH)2 ⑤HCl ⑥N2的序号填空
(1)空气中含量最多的气体______________;
(2)日常生活中常用于调味、腌渍蔬菜和鱼肉的盐______________;
(3)目前我市农业部门正在农村大力推广使用沼气,其主要成分______________;
(4)用于金属表面除锈的酸__________。
14.(14分)学习化学是为了应用化学,造福人类。
Ⅰ.化学知识将在2008年北京奥运会的多个方面发挥重要的作用。
(1)举重运动员在抓杠铃前常擦一种白色粉末碳酸镁(MgCO3),则碳酸镁属于(填序号) ______________;
A.酸 B.碱 C.盐 D.氧化物
(2)今年5月11日,奥运圣火来到福建,据悉奥运火炬的燃料为丙烷。请根据下表信息写出丙烷的化学式:______________;
物质
甲烷
乙烷
丙烷
丁烷
戊烷
化学式
CH4
C2H6
C4H10
C6H12

(3)奥运火炬采用铝合金制作,其最主要是利用铝合金的_________(填序号)特点。
A.导热、导电性
B.耐腐蚀、硬度较大、密度小
C.有金属光泽,良好的延展性
Ⅱ.汶川大地震是新中国成立以来破坏性最强的一次地震。灾后防疫部门用2%的漂白粉溶液对环境进行喷洒杀菌消毒。现代工业采用把氯气和消白灰或石灰乳反应的方法制取漂白粉。
(1)已知反应的化学方程式为:2Cl2+2Ca(OH)2==X+Ca(ClO)2+2H2O,则X的化学式为____________;
(2)商品漂白粉中含有Ca(ClO2)、Ca(OH)2、CaCl2等物质,其中有效成分是Ca(ClO)2,因此商品漂白粉是___________(填“混合物”或“纯净物”);
(3)在化学反应中,物质所含元素的化合价发生变化的就是氧化还原反应。根据(1)化学方程式中的Cl元素化合价变化情况判断该反应________(填“是”或“不是”)氧化还原反应;
(4)汶川大地震使当地居民的饮用水受污染,以下关于饮用水处理方法不合理的是________(填序号)。
A.用明矾使悬浮物沉降下来
B.用漂白粉进行消毒杀菌
C.只要无色透明的水就可以放心饮用
D.饮用前加热煮沸
15.(8分)草酸(化学式:H
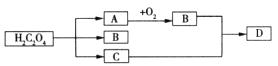
(1)推断A、B、C、D四种物质:
A__________;B__________;C__________;D__________;
(2)写出草酸在浓硫酸催化作用下加热分解的化学方程式:
________________________________________;
(3)A、B两物质所含的元素相同,而它们的化学性质不同,其原因是(填序号) __________。
A.两种物质所含的氧元素的质量分数不同
B.构成两物质的分子不同
C.两物质的相对分子质量不同
四、(本题包括2小题,共28分)
16.(14分)下图所示为实验室常用的实验装置,据此回答下列问题:
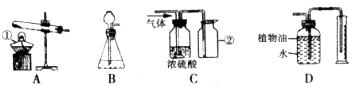
(1)写出带标号仪器的名称:①___________________;②___________________;
(2)实验室通过下图所示的两种途径都可以得到氧气。写出甲途径制取氧气的化学方程式:__________________________。化学实验绿色化的特点是:原料、产物、条件无毒无害,提高原子的利用率。从绿色化学的理念考虑,________(填“甲”或“乙”)途径更能体现化学实验的绿色化追求。
(3)实验室可用碳酸氢钠(NaHCO3)固体加热分解(产物为碳酸钠、二氧化碳和水)来制取二氧化碳,该反应的化学方程式为_____________________________,该反应的发生装置应选择(填序号) ________________。
(4)氧气和二氧化碳均可用C装置来干燥并收集,从C装置来看,氧气和二氧化碳具有的相同性质是:________________________。D装置可用来测量生成的二氧化碳的体积,其中在水面上放一层植物油的目的是(填序号) ______________。
A.防止二氧化碳溶于水
B.增加容器中液体的重量
C.防止水分蒸发
17.(14分)Na2CO3俗称纯碱,其溶液去油污效果较好。Na2CO3溶液能使酚酞试液变为红色。
(1)碳酸钠溶液的pH________7(填“大于”、“小于”或“等于”);
(2)甲同学想探究是Na+还是CO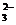 的作用使酚酞试液变红,其设计方案如下:先往Na2CO3溶液中滴加酚酞试液后,再加入适量的Ca(OH)2溶液,观察红色是否消失。
的作用使酚酞试液变红,其设计方案如下:先往Na2CO3溶液中滴加酚酞试液后,再加入适量的Ca(OH)2溶液,观察红色是否消失。

①老师肯定了乙同学的看法,你认为甲同学方案的不合理之处是:__________________;
②我想设计一个实验方案证明是否是CO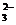 的作用使酚酞试液变红。在下列物质中选用一种可行的试剂是(填序号)___________;
的作用使酚酞试液变红。在下列物质中选用一种可行的试剂是(填序号)___________;
A.HCl B.NaOH C.CaCl2
实验操作
实验现象
实验结论
(3)丙同学发现碳酸钠碱性强弱与溶液的浓度和温度有关,采用以下三个实验步骤来研究,请简要写出第二步的实验步骤(不必写出实验所涉及的仪器)
第一步:分别配制溶质的质量分数为5%、10%、15%、20%的碳酸钠溶液,用pH试纸分别测定它们的pH,并记录;
第二步:__________________________________;
第三步:根据实验现象,综合分析,得出结论。
五、(本题l0分)
18.小君同学要配制
(1)该同学需称取氢氧化钠固体的质量为_____________g;
(2)从所配制的溶液中取出
(3)若根据科学检测,所配制的氢氧化钠溶液溶质质量分数小于8%,请你写出造成此结果的两种可能原因。
原因一:_______________________________;
原因二:_______________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com