
高一化学同步测试综合复习
YCY
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分.共120分,考试用时120分钟.
第Ⅰ卷(选择题,共58分)
以下数据可供解题时参考:
相对原子质量H1 O16 Na23 S32 K39
一、选择题(本题包括10小题,每小题1分,共10分。每小题只有一个选项符合题意)
1.以前媒体报道北京发生过一个大学生用浓硫酸伤害动物园黑熊的事件,这一违背社会公
德的行为受到了人们的普遍谴责,从化学的角度看,浓硫酸伤害黑熊最主要表现了它的
( )
A.强酸性 B.吸水性 C.脱水性 D.催化性
2.2003年月
查获用工业双氧水加工过的鱼翅成品和开心果等食品。食用工业双氧水加工的食品会致
癌致畸形。不法厂家用工业双氧水加工鱼翅和开心果使其增白是利用H2O2的 ( )
A.不稳定性 B.强氧化性 C.还原性 D.弱酸性
3.在火车上使用的一种玻璃杯震落到地上一般不会被打碎,公交车的窗玻璃一旦打破即变
成无尖锐棱角的小碎片,不会伤人,这种玻璃是 ( )
A.普通钠玻璃 B.石英玻璃 C.光学玻璃 D.钢化玻璃
4.下列所述情况可能引起水污染的是 ( )
①城市生活污水的任意排放。②农业生产中农药,化肥使用不当。③海上油轮石油泄漏。
④工业生产中废液、废渣、废气的排放
A.只有①② B.只有①④ C.只有②④ D.①②③④
5.为了保护臭氧层,可采取的有效措施是 ( )
A.减少二氧化硫的排放量 B.减少含铅废气的排放量
C.减少氟氯代烃的排放量 D.减少二氧化碳的排放量
6.当航天飞机返回地球进入大气层时,由于空气的剧烈摩擦,航天飞机尖端的温度可达到
1000度以上,为了防止极高的温度将其烧毁,科学家给航天飞机相应的部位设计安装了
可靠的保护层。制作保护层的材料可能为 ( )
A.合成塑料 B.玻璃 C.镁铝合金 D.新型陶瓷
7.大理石可以用作墙面、地面和厨房桌面,其主要成份是碳酸钙、食醋不慎滴在大理石桌
面上,会使其失去光泽,变得粗糙,下列能正确解释此现象的是 ( )
A.食醋中的水使碳酸钙溶解
B.食醋中的醋酸将碳酸钙氧化
C.食醋中的醋酸与碳酸钙反应并放出大量的二氧化碳气体
D.食醋中的醋酸与碳酸钙发生了复分解反应
8.据报道,月球上有大量3He存在,以下关于3He的说法正确的是 ( )
A.是4He的同素异形体 B.比4He多一个中子
C.是4He的同位素 D.比4He少一个质子
9.2001年美国的IBM公司制造出了第一批纳米碳晶体管,发明了利用电子波性来传递信息
的“导线”。下列有关纳米碳的说法中正确的是 ( )
A.纳米碳是一种新型高分子化合物
B.纳米碳的化学性质很稳定
C.纳米碳的结构和化学性质与金刚石相同
D.纳米碳的导电过程属于化学变化
10.近期《美国化学会志》报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在
A.由二氧化碳合成金刚石是化学变化 B.金刚石是碳的一种同位素
C.钠被氧化最终生成碳酸钠 D.金刚石中只含有非极性共价键
二、选择题(本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意)
11.下列各组化合物中,化学键类型完全相同的是 ( )
A.H2O和Na2O B.NaOH和NaCl C.H2O2和Na2O2 D.CCl4和HCl
12.下列关于电子运动的描述中,不正确的是 ( )
A.核外电子绕核作高速的圆周运动
B.在多电子原子中,能量低的电子通常在离核近的区域内运动
C.核外电子总是先排在能量低的电子层上,例如只有排满了M层后才排N层
D.核外电子的运动速率接近光速
13.具有下列特征的元素,一定是主族元素的是 ( )
A.原子序数为86 B.最外层只有2个电子
C.次外层排满18个电子 D.最外层有4个电子
14.不能说明氧元素比硫元素非金属性强的事实是 ( )
A.热稳定性H2O比H2S强
B.H2S水溶液在空气中变浑浊
C.H2O比H2S的沸点高
D.在一定条件下,O2与Cu反应生成CuO,S与Cu反应生成Cu2S
15.下列说法中不正确的是 ( )
①质子数相同的粒子一定属于同种元素;②同位素的性质几乎完全相同;③质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;④电子数相同的粒子不一定是同一种元素;⑤一种元素只能有一种质量数;⑥某种元素的相对原子质量取整数,就是其质量数。
A.①②④⑤ B.③④⑤⑥ C.②③⑤⑥ D.①②⑤⑥
16.为除去CO2中混有的SO2和O2,下列试剂使用顺序正确的是 ( )
①饱和的Na2CO3溶液、②饱和的NaHCO3溶液、③浓硫酸、④灼热的铜网、⑤碱石灰
A.①③④ B.②③④ C.②④③ D.③④⑤
17.放在敞口容器中的下列溶液,久置后溶液中该溶质的浓度会变大的是 ( )
A.浓硫酸 B.氢氧化钠溶液 C.氯水 D.氯化钠溶液
18.已知氢化锂(LiH)属于离子化合物;LiH跟水反应可以放出氢气,下列叙述正确的是( )
A.LiH的水溶液显中性 B.LiH中的氢离子可以被还原成氢气
C.LiH是一种强氧化剂 D.LiH中氢离子比锂离子的半径大
19.30ml 0.1mol?l-1的Na2SO3溶液恰好将2×10-3 mol的XO4-还原,则元素X在生成物中的化合价是 ( )
A.+4价 B.+3价 C.+2价 D.+1价
20.硼有两种天然同位素510B和511B,硼元素的相对原子质量为10.80,则硼元素中510B质量分数约为 ( )
A.20% B.80% C.18.5% D.21.5%
三、选择题(本题包括14小题,每小题2分,共28分。在每题给出的四个选项中,有一个或两个选项符合题意)
21.下列反应既表现浓硫酸的酸性,又表现其氧化性的是 ( )
A.C + H2SO4(浓)→CO2 + SO2↑+ H2O
B.Cu+H2SO4(浓)→CuSO4 + SO2↑+ H2O
C.FeO + H2SO4(浓)→Fe2(SO4)3 + SO2↑+ H2O
D.Na2CO3 + H2SO4(浓)→ Na2SO4 + CO2↑+ H2O
22.下列物质既能跟盐酸反应,又能跟NaOH反应的是 ( )
A.Na2CO3 B. NaHCO
23.设NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.
B.常温常压下,0.1mol氦气含有0.1NA个原子
C.标准状况下,
D.
24.下面各组离子在溶液中能大量共存的是 ( )
A.Ba2+、K+、HCO3-、CO32- B.Na+、H+、、SO42-、 SO32-
C.Al3+、Mg2+、Cl-、OH- D.S2-、SO32-、K+、OH-
25.下列反应中,离子方程式正确的是 ( )
A.氢氧化铝溶于盐酸 H++OH-=H2O
B. KOH溶液与过量的SO2反应: OH-+SO2==HSO3-
C.将SO2通入漂白粉溶液中 Ca2++2ClO-+ SO2+ H2O=CaSO3↓+2H++2ClO-
D.稀硫酸溶液滴加到氢氧化钡溶液中 Ba2++ OH-+ H++ SO42-= BaSO4+ H2O
26.核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核有NMR现象。试判断下列哪组原子均可产生NMR现象 ( )
A.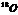
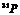
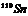 B.
B.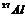
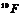
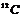
C.元素周期表中VA族所有元素的原子 D.元素周期表中第1周期所有元素的原子
27.氧族元素A 和B 形成A2- 和B2- 时,A 放出的能量大于B ,则 ( )
A.单质氧化性:A < B B. 原子序数:A > B
C.离子还原性:A2-< B2- D. 离子氧化性:A2- > B2-
28.酸根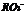 所含电子数比
所含电子数比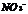 的电子数多10 ,则下列说法中正确的是 ( )
的电子数多10 ,则下列说法中正确的是 ( )
A.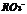 中R的化合价与
中R的化合价与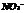 中N的化合价相等
中N的化合价相等
B.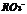 和
和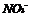 只能被还原不能被氧化
只能被还原不能被氧化
C.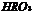 酸性比
酸性比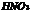 强
强
D.R在周期表中的VIA 族或VIIA族
29.M元素的一个原子失去两个电子转移到R元素的两个原子中去,形成离子化合物,下列说法中不正确的是 ( )
A.M与R形成化合物的化学式为MR2
B.M元素的原子半径一定比R元素的半径大
C.M与R形成的离子化合物一定溶于水
D.M与R形成的离子化合物的晶体一定不导电
30.将1体积选项中的一种气体与10体积O2混和后,依次通过盛有足量浓NaOH溶液的洗气瓶和盛有足量灼热铜屑的管子(假设反应都进行完全),最后得到的尾气是 ( )
A.Cl2 B. CO C. CO2 D. N2
31.把SO2通入NaOH溶液中,当SO2和NaOH完全反应时,其质量比为6:5,则下列说法正确的是 ( )
A.反应后SO2有剩余 B.溶液还可吸收SO2
C.溶液中除OH-外,只存在一种阴离子D.溶液中溶质的物质的量之比为1:2
 32.汽车尾气(含有碳氢化合物CO、NO和SO2等)是城市空气的主要污染源。治理方法之一是在汽车排气管上加装“催化转化器”,它使CO和NO反应生成可参与大气生态环境循环的无毒气体,并促使碳氢化合物充分燃烧及SO2的转化。下列说法中错误的是( )
32.汽车尾气(含有碳氢化合物CO、NO和SO2等)是城市空气的主要污染源。治理方法之一是在汽车排气管上加装“催化转化器”,它使CO和NO反应生成可参与大气生态环境循环的无毒气体,并促使碳氢化合物充分燃烧及SO2的转化。下列说法中错误的是( )
A.CO和NO反应的化学方程式2NO + 2CO 2CO2 + N2
B.此方法的缺点是由于CO2的增多,会大大提高空气的酸度
C.汽车改用天然气为燃料或开发氢能源,都会减少对空气的污染
D.增大绿化面积,多植树造林,可有效控制城市空气污染源
33.在 100mL 0.10 mol?L-1的 AgNO3溶液中加入100mL溶有
A.最终得到白色沉淀和无色溶液
B.最终得到的白色沉淀是等物质的量的两种化合物的混合物
C.在最终得到的溶液中,Cl-的物质的最为0.02 mol
D.在最终得到的溶液中,Cu2+的物质的量浓度为0.01 mol?L-1
34.已知2.1gKOH和
aKOH+bS=cK2Sx+dK2S2O3+eH2O 则x值为 ( )
A.0 B.
第Ⅱ卷(非选择题 共62分)
四、空、简答和计算
35.用化学用语回答下列问题:
(1)画出磷原子的原子结构示意图: _______。
(2)写出H2S分子的电子式: 。
(3)用电子式表示氯化镁的形成过程: _____ 。
(4)写出碳酸钡中加入稀盐酸的离子反应方程式 ________ 。
(5)写出在加热条件下铜片和浓硫酸反应的化学方程式并标明该反应过程中电子转移的方向和数目: ______________________________________
36.如果给原子核外的电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:A、原子核对核外电子的吸引力 B、形成稳定结构的倾向。
下表是一些主族元素气态原子失去核外不同电子所需的能量(kJ/mol )
锂
X
Y
失去第一个电子
519
502
580
失去第二个电子
7296
4570
1820
失去第三个电子
11799
6920
2750
失去第四个电子
9550
11600
(1)通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量
(2)表中X可能为 元素(填写字母)。
A.H B.Be C.Na D.Si E. S
(3)Y可能是元素周期表中 族元素,你判断的依据是____________________
37.(1)将等物质的量的Cl2和SO2气体通入滴有石蕊试液的BaCl2溶液中,出现的现象是______________________________,简述产生此现象的原因____________________
_____________________________________。
(2)在CO2中混有少量的SO2、SO3、HCl杂质。请用 ① 饱和NaHCO3 ② 饱和NaHSO3 ③ 浓硫酸(可吸收SO3 ,可重复使用)三种试剂,设计一种一步只除去一种杂质,最后得到干燥纯净CO2的实验方案,填写下表。(试剂用编号表示)
依次选用的试剂
除去的杂质
38.有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A B __________ C __________ D ___________
(2)写出AB2与过量氢氧化钠反应的离子方程式 ______________
(3)画出D的原子结构示意图 ____________ _______, 用电子式表示化合物 C2D 的形成过程 _______________________________ _ _____。
39.已知A是一种不溶于水的酸酐。根据下图转化关系回答:
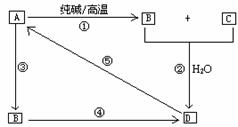
(1)A是 ,B是 ,D是 。
(2)写出①→⑤各步反应的化学方程式,如是离子反应请改写离子方程式。
① ②
③ ④
⑤
40.某待测溶液(阳离子为Na+)中可能会有SO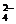 、S2-、SO
、S2-、SO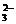 、Cl-、Br-、NO
、Cl-、Br-、NO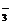 、CO
、CO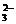 、HCO
、HCO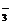 中的一种或若干种。进行下列实验(如下图所示)(每次实验所加试剂均过量):
中的一种或若干种。进行下列实验(如下图所示)(每次实验所加试剂均过量):
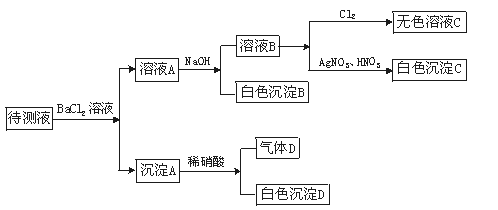
(已知:气体D可使澄清石灰水变浑浊)
回答以下问题:?
(1)待测液是否含有SO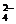 、SO
、SO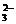 ?答:
?答:
(2)沉淀B的化学式为 。
(3)根据以上实验,待测液中肯定没有的离子是 ,
肯定存在的离子是 。
41.A、B、C是三种短周期元素的单质,甲、乙是两种常见的化合物,这些单质、化合物之间存在如下图所示关系,反应条均件未注明,回答下列问题:

下列(1)~(3)中的A不在同一主族。
(1)若A为ⅢA族元素,则A是__________,B为________,C为______。
(2)若化合物甲在常温、常压下为液态,则组成化合物甲的元素所属类别为_________(填金属或非金属),单质A与化合物甲反应的化学方程式为: ________________。
(3)若化合物乙为氧化物,则化合物甲所属物质类别为___________(填酸、碱、盐、氧化物、氢化物),单质A与化合物甲反应的化学方程式为:____________________。
42.下图虚线框中的装置可用来检验浓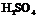 与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:
与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白:
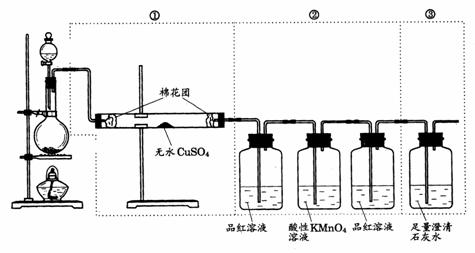
(1)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是________;不能检出的物质是_____________.
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是________;不能检出的物质是________.
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是________;不能检出的物质是________.
43.某元素Y,0.5molY的离子得到6.02×1023个电子被还原为中性原子,0.4gY的氧化物恰好与100mL0.2mol/L的盐酸完全反应,Y原子核内质子数与中子数相等。写出(1)Y的名称及它在元素周期表中位置。(2)Y的氧化物与盐酸反应的离子方程式。
44.现有物质的量浓度为18.4
mol/L的浓硫酸20.0 mL,加入铜屑共热一段时间后,冷却,滤去多余的铜屑,将滤液加水到100.0 mL,测得溶液中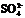 的物质的量浓度为3.18 mol/L.试求该100.0 mL溶液中
的物质的量浓度为3.18 mol/L.试求该100.0 mL溶液中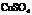 的物质的量浓度.
的物质的量浓度.
45.H2S气体可以在氧气中燃烧,反应方程式为:2H2S+O2=2H2O+S
或2H2S+3O2==2H2O+2SO2。 在1个大气压,20ºC条件下,将amolH2S与1mol O2混合点燃完全反应。若a的取值不同,H2S的氧化产物可能不同:
(1)若氧化产物全部为SO2,此时a的取值范围是多少?
(2)若氧化产物全部为S,此时a的取值范围是多少?
(3)氧化产物部分是SO2,部分是S,此时a的取值范围是多少?此时生成的SO2的物质的量等于多少?
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
C
B
D
D
C
D
C
C
B
B
二、选择题
题号
11
12
13
14
15
16
17
18
19
20
答案
D
A
D
C
D
B
D
D
A
C
三、选择题
题号
21
22
23
24
25
26
27
28
29
30
答案
BC
BD
BD
D
B
C
C
A
BC
BD
题号
31
32
33
34
答案
BC
B
AB
D
 四、填空、简答和计算
四、填空、简答和计算
 35. (1)
(2)
35. (1)
(2)
 |
(3)
(4)BaCO3+2H+==Ba2++CO2↑+H2O
 |
 (5)Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O
(5)Cu+2H2SO4(浓)===CuSO4+SO2↑+2H2O
36.(1)Li 原子失去一个电子后, Li+已经形成了稳定结构,此时再失去电子很困难。
(2) C ;(3) ⅢA族,失去第四个电子时所需能量远远大于失去前三个电子所需能量 。
37.(1)产生白色沉淀,试液变成红色;因为在水中SO2和Cl2反应生成盐酸和硫酸,使石蕊试液变红色,硫酸与BaCl2溶液反应产生BaSO4 沉淀。 (2)③、SO3;②、HCl;①、SO2;③、H2O。
38.(14分)(1)碳、氧、钠、硫(2)CO2+2OH-=H2O+CO32-
(3)
 。
。
39.⑴SiO2 Na2SiO3 H2SiO3
⑵

40.(1)
含有SO 或SO
或SO 中的一种或两种都有。
中的一种或两种都有。
(2) BaCO3;(3)
Br-、S2-
; HCO (除SO
(除SO 或SO
或SO 以外)
以外)
41.(1)Al;H2 ;Cl2(2)非金属;
(3)氧化物或氢化物;SiO2+ Si+2CO↑或O2+H2S
Si+2CO↑或O2+H2S 2H2O+S(其它合理答案均可)
2H2O+S(其它合理答案均可)
42.(1) 、
、 ;
; (2)
(2) ;
; 、
、 (3)
(3) 、
、 ;
;
43.解: 0.5molY的离子得到6.02×1023个电子(即1mol电子)被还原为中性原子,所以1molY应得到2mol电子还原为中性原子,即Y离子应带2个带电荷,则其氧化物的化学式应为YO。
YO + 2HCl=YCl2+H2O
(Y+16)g 2mol
∴ =
=
∴Y=24
又∵Y核中质子数等于中子数,∴Y的质子数为12,应是Mg,位于第三周期ⅡA族。
MgO+2H+=Mg2++H2O
44.解:
由方程式可知: =n(被还原的
=n(被还原的 )
)


45. (1)a≤2/3;(2)a≥2; (3) 2/3<a<2, (1?a/2)mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com