
题目列表(包括答案和解析)
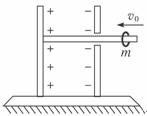
25.(20分)如图所示,电容器固定在一个绝缘座上,绝缘座放在光滑水平面上,平行板电容器板间距离为d,电容为C,右极板有一个小孔,通过小孔有一长为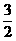 d的绝缘杆,左端固定在左极板上,电容器极板连同底座、绝缘杆总质量为M。给电容器充入电量Q后,有一质量为m的带电量+q的环套在杆上以某一初速度v0对准小孔向左运动(M=3m)。设带电环不影响电容器板间电场的分布,电容器外部电场忽略不计。带电环进入电容器后距左板最小距离为
d的绝缘杆,左端固定在左极板上,电容器极板连同底座、绝缘杆总质量为M。给电容器充入电量Q后,有一质量为m的带电量+q的环套在杆上以某一初速度v0对准小孔向左运动(M=3m)。设带电环不影响电容器板间电场的分布,电容器外部电场忽略不计。带电环进入电容器后距左板最小距离为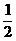 d。试求:
d。试求:
(1)带电环与左极板间相距最近时的速度;
(2)若取左板的电势能为零,当环距左板最近时环的电势能;
(3)带电环受绝缘杆的摩擦力。
答案:(1)当带电环距左板最近时,环和电容器等达到共同速度V
由动量守恒定律得mv0=(M+m)V(3分)
V=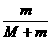 v0=
v0=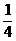 v0(3分)
v0(3分)
(2)环在距左板最近时的电势能ε=-q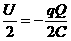 (3分)
(3分)
(3)设从开始到环距左板最近的过程中,电容器移动的距离为s
由动能定理得
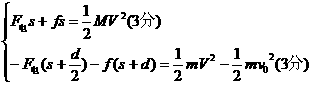
其中F电=qE=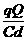 (2分)
(2分)
解之得:f=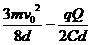 (3分)
(3分)
24.(19分)国家飞蝶射击队在进行模拟训练时用如图所示装置进行。被训练的运动员在高H=20 m的塔顶,在地面上距塔水平距离为s处有一个电子抛靶装置,圆形靶可被以速度v2竖直向上抛出。当靶被抛出的同时,运动员立即用特制手枪沿水平射击,子弹速度v1=100 m/s。不计人的反应时间、抛靶装置的高度及子弹在枪膛中的运动时间,且忽略空气阻力及靶的大小。(g取10 m/s2)
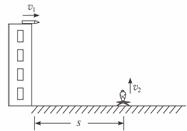
(1)当s取值在什么范围时,无论v2为何值都不能被击中?
(2)若s=100 m,v2=20 m/s,试通过计算说明靶能否被击中。
答案:(1)若抛靶装置在子弹的射程以外,则不论抛靶速度为何值,都无法击中。
由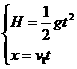 得s>x=v1
得s>x=v1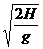 =200 m
=200 m
当s>200 m时,无论v2为何值靶都不能被击中。(6分)
(2)若靶能被击中,则击中处应在抛靶装置的正上方,设经历的时间为t1,则
s=v1t1
t1=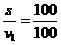 s=1 s(3分)
s=1 s(3分)
y1=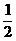 gt12=
gt12=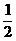 ×10×12 m=5 m(3分)
×10×12 m=5 m(3分)
y2=v2t1-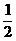 gt12=15 m(3分)
gt12=15 m(3分)
∵y1+y2=5 m+15 m=20 m=H,
∴靶恰好被击中。(4分)
23.(16分)一辆电动自行车的铭牌上给出了如下的技术参数表
|
规格 |
|
后轮驱动直流电机 |
|
|
车型 |
26″电动自行车 |
额定输出功率 |
120 W |
|
整车质量 |
30 kg |
额定电压 |
40 V |
|
最大载量 |
120 kg |
额定电流 |
3.5 A |
质量为M=70 kg的人骑此电动自行车沿平直公路行驶,所受阻力F阻恒为车和人总重的k=0.02倍,g取10 m/s2,求:
(1)此车电机的内阻和正常工作时的效率;
(2)仅在电机正常工作时,人骑车行驶的最大速度。(g取10 m/s2)
答案:(1)由表可知电机的输出功率为P出=120 W,额定电压为U0=40 V,额定电流为I0=3.5 A。
电机正常工作时输入功率为:
P入=U0I0=40×3.5=140 W(3分)
所以电机的效率为:
η=P出/P入=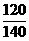 =85.7%(3分)
=85.7%(3分)
设电机的内阻为r,则由欧姆定律知:
P入-P出=I02r(3分)
解得η=85.7% r=1.63 Ω(3分)
(2)设车的质量为m,由题意知行驶时所受阻力为F阻=k(M+m)g
当达到最大速率vm时,应有P出=F阻vm(3分)
解得:vm=6.0 m/s(1分)
22.(17分)给你以下器材:待测直流电源1个(电动势未知,内阻约几欧),电阻箱1个,电流表1个,电流表表盘有刻度但无刻度值,量程符合要求,开关1个,另有导线若干条。
(1)请在方框中画出用以上有关器材测量电源内阻的电路图。(电阻箱的符号为 )
)

(2)请根据所用的器材情况,说明实验操作方案及要记录的数据,并根据你所测出的数据导出电源内阻的表达式。用该实验方案测电源内阻引起误差的原因是什么?
答案:(1)电路图如图所示:(4分)
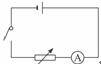
(2)连接好电路闭合开关后,调节电阻箱,记录对应的电阻箱的电阻R1、R2和对应的电流表指针所指的刻度n1、n2(3分)
设电流表的分度值(每格代表的电流值)I0,由闭合电路欧姆定律得
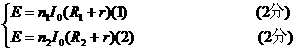
r=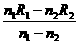 ③(3分)
③(3分)
引起内阻测量误差的主要原因是电流表的内阻。(3分)
31.(22分)糖尿病是日常生活中的常见病,发病率有上升的趋势,下图是人体内的血糖平衡调节示意图,请根据图完成下列问题。
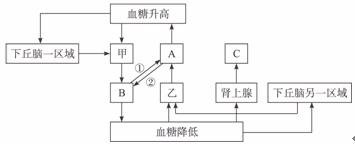
(1)图中甲、乙分别表示____________(结构),A、B、C分别表示____________(激素)。
(2)图中①的作用效果是____________,②的作用效果是____________。
(3)图中具有协同作用与拮抗作用的激素分别是____________、____________(用图中字母表示)。
(4)人体内血糖浓度高于____________时,会出现尿糖。血糖平衡是____________调节的结果。
(5)当葡萄糖在细胞中进行无氧呼吸,其产物进入血液可与____________(填“Na2CO3”或“NaHCO3”)发生反应,此反应的生理意义是________________________。
(6)当体内胰岛素含量过高时动物会出现惊厥、昏迷现象(低血糖晚期症状)。现有如下材料,请设计实验说明当动物出现低血糖晚期症状时,静脉注射葡萄糖可缓解症状。
材料:身体状况相同的健康小白鼠数只、1 mL注射器、50%葡萄糖水溶液(每次用量?0.01 mL/g)、蒸馏水、用酸性生理盐水配成的胰岛素溶液(2U/ mL)(每次用量0.1 mL/10g)、酸性生理盐水。
①实验步骤:
a.获取实验材料并分组:取数只身体状况相同的健康小白鼠平均分成甲、乙两组,同时注入等量的____________溶液,当____________时备用。
b.实验组:甲组小鼠及时从静脉注入_______________。
c.对照组:乙组小鼠同时注入等量的_______________。
d.培养观察:在相同培养条件下培养,观察小白鼠情况。
②预期实验结果:________________________________________________________________
③实验结论:____________________________________________________________________
④借鉴上述实验及相关内容回答下列问题:
e.胰岛素含量升高引起惊厥现象的原因是___________________________________________。
f.假如人体出现类似的低血糖晚期症状时可采取的措施是_____________________________。
答案:(1)胰岛B细胞、胰岛A细胞(顺序颠倒不给分,2分) 胰高血糖素、胰岛素、肾上腺素(缺一不可,顺序颠倒不给分,2分)
(2)抑制(1分) 促进(1分)
(3)A与C(1分) A与B(或C与B)(1分)
(4)160 mg/dl(1分) 神经--激素(2分)
(5)NaHCO3(1分) 维持内环境pH的稳定(2分)
(6)①a.用酸性生理盐水配成的胰岛素(1分)
出现惊厥现象(1分)
b.适量的葡萄糖水溶液(1分)
c.蒸馏水(1分)
②甲鼠昏迷状况得到缓解,乙鼠因昏迷时间长会死亡。(1分)
③当动物出现低血糖晚期症状时,静脉注射葡萄糖可缓解症状。(1分)
④e.脑部需要的能量主要来自血液中葡萄糖分解产生的能量(1分)
f.静脉注射葡萄糖溶液(1分)
解析:本题考查的是血糖调节。血糖平衡是神经-激素调节的结果,神经调节的中枢是下丘脑,激素调节中激素主要有胰岛素、胰高血糖素、肾上腺素。其中胰岛素与后两者是拮抗作用,胰高血糖素与肾上腺是协同作用。当人体血糖高于160 mg/dl时就会出现糖尿。第(6)问实验组注射葡萄糖溶液,对照组注射蒸馏水。预期结果:甲昏迷状态得到缓解,乙继续昏迷,甚至死亡。结论:静脉注射葡萄糖可缓解昏迷症状。
30.(20分)下图是体内细胞与内环境之间的物质交换示意图,根据图完成下列问题:
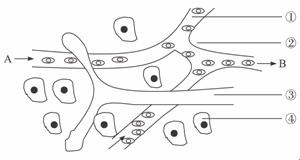
(1)毛细血管壁细胞生活的具体的内环境是______________。(填标号)
(2)内环境各成分之间的关系可表示为______________(用标号和箭头),某人喝了大量的醋后是否会引起内环境中的pH下降?______________,原因是图中标号______________内存在着______________物质。
(3)在一些病理条件下,血浆、组织液和淋巴液三者的两者都可能发生变化,请举出由于病理原因引起②增多的实例______________。
(4)如果图中④细胞是B淋巴细胞,其参与人体特异性免疫中的______________免疫。
(5)如果该图为肝脏的局部结构模式图,当患肝炎时,则B端与A端的液体相比,明显增加的物质有______________等。
(6)如该图为鼻粘膜的局部结构模式图,当过敏原再次进入机体时,与吸附在______________表面的______________结合,细胞产生了某种化学物质,该物质会使______________(填标号)通透性增强,引起鼻粘膜水肿。
答案:(1)①②(2分)
(2)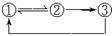 (2分) 不会(1分) ①(1分) 缓冲(2分)
(2分) 不会(1分) ①(1分) 缓冲(2分)
(3)血浆蛋白减少、毛细淋巴管堵塞、过敏反应,毛细血管通透性增大(2分)
(4)体液(2分)
(5)谷丙转氨酶(2分)
(6)④(2分) 抗体(2分) ①(2分)
解析:内环境各成分之间的关系: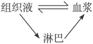 ,毛细血管壁细胞比较特殊,内环境为血浆和组织液。由于人体内有缓冲物质,故喝了大量的醋后pH不会有较大下降。
,毛细血管壁细胞比较特殊,内环境为血浆和组织液。由于人体内有缓冲物质,故喝了大量的醋后pH不会有较大下降。
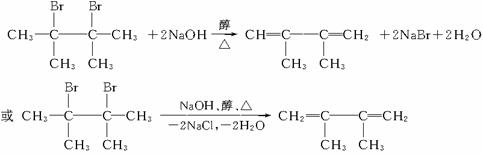
29.(18分)卤代烃在碱性醇溶液中能发生消去反应。例如
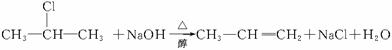
该反应也可表示为: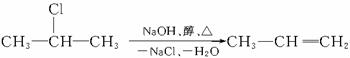
下面是八个有机化合物的转换关系:
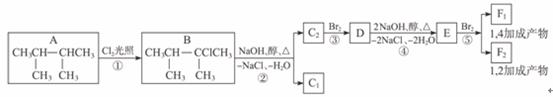
请完成下列问题:
(1)根据系统命名法,化合物A的名称是__________________。
(2)上述框图中,①是________________反应,③是________________反应。(填反应类别)
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:________________。
(4)C2的结构简式是________________。
F1的结构简式是________________。
F1和F2互为________________。
(5)上述八个化合物中,属于二烯烃的是_____________。二烯烃的通式是______________。
答案:(每空2分)(1)2,3-二甲基丁烷
(2)取代 加成
(3)
(4)(CH3)2C====C(CH3)2 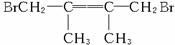 同分异构体
同分异构体
(5)E CnH2n-2
解析:本题的前两问比较简单,第(1)问考查有机物的命名,第(2)问考查有机反应的基本类型,第(3)、(4)问则是利用有关反应和性质来确定物质的结构,由B的结构及反应条件可知C1、C2可能为(CH3)2CHC(CH3)====CH2或(CH3)2C====C(CH3)2,由于E可发生1,4-加成和1,2-加成,则E为二烯烃,不难推得C2为(CH3)2C====C(CH3)2,D为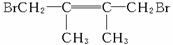 ,其他问题便可迎刃而解了。
,其他问题便可迎刃而解了。
28.(14分)(1)取一支试管,加入15 mL蒸馏水,再加入5 mL己烷,静置,取黄豆大的金属钠(ρ=?0.97 g·cm-3),轻轻放入这只装有水和己烷的试管中。试推测能观察到的实验现象是_______________。
(2)取另一支试管,加入15 mL蒸馏水和5 mL己烷,静置,取黄豆大的金属钾(ρ=0.86 g·cm-3)轻轻放入其中。
如(1)和(2)两个实验中金属钠和金属钾都是同时投入液体中,试推测哪种金属先消耗完?分析原因。
答案:(1)钠块表面落在己烷和蒸馏水的界面上,与水接触时钠表面会有气泡产生。气泡积累到一定量时会产生较大的浮力使钠块上升,当附着在钠块表面的氢气逸出后,钠块又下沉到水和己烷的界面上,又发生反应,重复发生上述现象直到钠耗尽(7分)
(2)我们知道,若把同样大小的钠、钾分别放入水中,由于钾比钠活泼,钾跟水反应的现象明显比钠剧烈,钾消耗完的时间比钠要短。但在该题实验中,由于钾、钠的密度大小不同,在浮力的影响下,就会产生出人意料的现象。钾的密度比钠的密度小,因此钾在己烷中上浮只需较小的浮力,较少量的气泡就可使钾上浮,所以钾与水接触的时间会更短,上下运动时间会更长,反应消耗完的时间也就更长。(7分)
解析:实验现象包括反应前的现象、反应中的现象和反应后的现象。钠的密度小于水而大于己烷,所以起初应位于两种液体的界面上。当反应进行后,由于放出气体,从而使得钠粒所受液体的浮力增大,此时钠由二液体的界面进入己烷层。当气体逸出后,钠块所受的重力又大于浮力,于是又回落到界面上,再与水反应,再进入己烷层,如此反复进行,直到钠块消耗完。
若用钠块和钾块做对比实验,由于二者的体积近似相等,但二者的密度不同,所以钾块比钠块轻。这样钾块比钠块生成的气体还少时,就受浮力影响而进入己烷层,从而暂时停止与水的反应,这样钾比钠跳跃得更加频繁,虽比钠与水的反应要快,但每次与水接触的时间短,所以反应所用的时间反而长。
27.(14分)在一定条件下进行下列化学反应,请根据以下的转化关系回答下列问题,已知?A、B、C中均含有同一种元素。
(1)已知: ,D为非金属单质。
,D为非金属单质。
①若A为非金属单质,则C可能为(只需回答一种,下同)________________。
②若A为某无机气态化合物,则C可能为________________。
③若A为日常生活中最常见的烃的衍生物,则C为________________。
(2)已知:
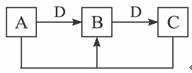
①若D为金属单质,且以上反应均为氧化还原反应,请写出检验B中阳离子的一种方法____________________。
②若D为碱,且以上反应均为非氧化还原反应,则A、B、C、D分别可以是:(按顺序写出合理的一组物质的化学式即可)A_______________,B_______________,C_______________,D_______________。
答案:(1)①SO3、NO2、CO2(或其他合理答案)
②SO2、SO3、NO2(或其他合理答案) ③CH3COOH(每空2分,共6分。只需回答一种即可)
(2)①向FeCl3溶液中滴加少量KSCN溶液,溶液呈红色(4分)(其他合理答案参照给分)
②AlCl3 Al(OH)3 NaAlO2 NaOH(或H2S、NaHS、Na2S、NaOH)(每空1分,共4分。其他合理答案参照给分)
解析:(1)题目中所示反应关系,最容易让人联系到某物质的两次氧化,即D为O2。因此①若A为非金属单质,则C可能是NO2(或SO3);②若A为某无机气态化合物(如:NH3),则C可能为NO2;③日常生活中最常见的烃的含氧衍生物为乙醇,因此C为乙酸。
(2)根据题给反应关系,①若D为金属单质,则可以是锌,A可以是FeCl3,锌适量时,Zn+2FeCl3====ZnCl2+2FeCl2;锌过量时,Zn+FeCl2====ZnCl2+Fe,且Fe+2FeCl3====3FeCl2符合题意,所以B为FeCl2,检验B中金属离子的方法是:向其溶液中滴加NaOH溶液,出现白色沉淀,迅速变为灰绿色,最后变为红褐色,则其溶液中有Fe2+。
②与碱能发生连续反应的最典型的物质是Al3+,则A可以是AlCl3,B是Al(OH)3,C是NaAlO2,D为NaOH。
26.(14分)A、B、C、D、E、F六种短周期元素的原子序数依次增大。已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。试完成下列问题:
(1)写出下列元素的符号:A________,D_______,E_______。
(2)用电子式表示B、F形成的化合物_______________。
(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式是________________。
(4)D的固态氧化物是___________晶体。含n mol D的氧化物的晶体中含D-O共价键为_____________mol。
答案:(1)Na Si P(6分)
(2)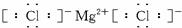 (2分)
(2分)
(3)Al(OH)3+OH-====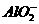 +2H2O(2分)
+2H2O(2分)
(4)原子 4n(4分)
解析:本题考查的是思维的严密性和连续性,是原子结构、周期表及元素化合物知识的综合应用。A、C、F三种元素最高价氧化物的水化物之间两两皆能反应,均能生成盐和水,确定其一必为Al,D原子的最外层电子数比次外层电子数少4个,确定D为Si,E原子的次外层电子数比最外层电子数多3个,确定E为P,又A、B、C、D、E、F六种短周期元素的原子序数依次增大,且A、C、F三原子的最外层共有11个电子,故A为Na,B为Mg,C为Al,F为Cl。在SiO2晶体中每个Si原子形成4个Si-O键。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com