
题目列表(包括答案和解析)
25.(20分)如图所示,将单匝正方形线框ABCD一半放入匀强磁场中,磁感应强度B=1 T,让它以边界OO′为轴,以角速度ω=100 rad/s匀速转动,在AB、CD的中点用电刷P、Q将电流输送给小灯泡,线框边长L=0.2 m,总电阻为r=4 Ω,灯泡电阻为R=2 Ω,不计P、Q接触电阻及导线电阻。求:
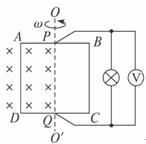
(1)线框转动过程中产生的最大感应电动势;
(2)理想电压表V的示数;
(3)由图示位置转过30°时,线框受到的安培力。
答案:(1)Em=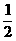 BL2ω=
BL2ω=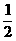 ×1×0.22×100 V=2 V
×1×0.22×100 V=2 V
(2)设外电路电阻为R′,则R′=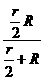 =1 Ω(4分),据欧姆定律得电压表示数为
=1 Ω(4分),据欧姆定律得电压表示数为
U=I·R=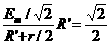 V≈0.48 V(4分)
V≈0.48 V(4分)
(3)转动30°时,通过AD的电流为i=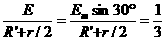 A,(4分)AD边受到的安培力为F安=BIL=
A,(4分)AD边受到的安培力为F安=BIL=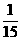 N(4分)
N(4分)
24.(19分)在电场强度为E的匀强电场中,有一条与电场线平行的几何线,如下图中虚线所示。几何线上有两个静止的小球A和B(均可看作质点),两小球的质量均为m,A球带电荷量+Q,B球不带电。开始时两球相距L,在电场力的作用下,A球开始沿直线运动,并与B球发生正对碰撞,碰撞中A、B两球的总动能无损失。设在各次碰撞过程中,A、B两球间无电量转移,且不考虑重力及两球间的万有引力,问:
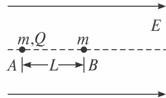
(1)A球经过多长时间与B球发生第一次碰撞?
(2)第一次碰撞后,A、B两球的速度各为多大?
(3)试问在以后A、B两球再次不断地碰撞的时间间隔会相等吗?如果相等,请计算该时间间隔T,如果不相等,请说明理由。
答案:(1)A球在电场力的作用下做匀加速直线运动a=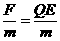 ,L=
,L=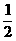 at2,联立①②得t=
at2,联立①②得t=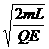 (6分)
(6分)
(2)A球与B球碰撞,动量守恒mvA=mv′A+mv′B,根据题意,总能量不损失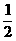 mv2A=
mv2A=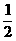 mv′2A+
mv′2A+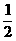 mv′2B,联立④⑤得v′A=0,v′B=vA=
mv′2B,联立④⑤得v′A=0,v′B=vA=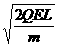 (6分)
(6分)
(3)取B球为参考系,A、B碰撞后,A球发vA向左做匀减速直线运动,经时间t后,速度减为0,同时与B球相距L,然后A球向右做匀加速直线运动,又经过时间t后,速度增为vA,与B球发生第二次碰撞,同②理可证,每次总能量无损失的碰撞均为互换速度,则以后第三、四次碰撞情况可看成与第一、二次碰撞的情况重复,以此类推可知A、B两球不断碰撞的时间间隔相等,均为T=2t=2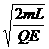 。(7分)
。(7分)
23.(16分)如图所示,A、B两同学在直跑道上练习4×100 m接力,他们在奔跑时有相同的最大速度。B从静止开始全力奔跑需25 m才能达到最大速度,这一过程可看作匀变速运动,现在A持棒以最大速度向B奔来,B在接力区伺机全力奔出。若要求B接棒时奔跑达到最大速度的80%,则
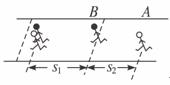
(1)B在接力区需跑出的距离s1为多少?
(2)B应在离A的距离s2为多少时起跑?
答案:(1)对B:设其加速度为a,跑出的距离为s时速度达到最大值v。
由2as=v2
有2as1=(0.8v)2(4分)
解得s1=0.64s=16 m(2分)
(2)B接棒时跑出时间为t
s1=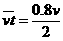 t(4分)
t(4分)
在t时间内,对A有sA=vt
解得sA=40 m(4分)
所以B起跑时,应在距离A为Δs=sA-s1
得Δs=s2=24 m。(2分)
22.(17分)科学实验是人们认识自然的重要手段。电学实验中经常需要测量某负载的电阻。
(1)测电阻的方法有多种,现在有一只标有“220 V,100 W”灯泡,它正常工作时的电阻为_________Ω。若用多用电表中欧姆挡来测量这只灯泡的电阻,则测出的电阻应_________灯泡正常工作时电阻(填“大于”“等于”“小于”)。这是因为__________________。
(2)请用下列器材设计一个实验,测定灯泡正常工作时的电阻值。
A.220 V交流电源
B.单刀双掷开关一只
C.电阻箱一只(0-999 Ω,额定电流1 A)
D.交流电表一只(0-0.6 A)
E.导线若干
①请在方框内画出电路原理图。

②写出简单实验步骤。
答案:(1)484 小于 灯泡电阻随温度变化而变化,温度越高电阻越大(每空2分)
(2)①电路原理图如图所示:(3分)
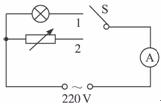
②a.按原理图连好电路,电阻箱阻值置于最大值。
b.单刀双掷开关置于1位置,读出电流表读数I。
c.将单刀双掷开关置于2位置,调节电阻箱使电流表的读数仍为I。
d.读出电阻箱的阻值R,即为该灯泡电阻。(8分)
31.(22分)在生产生活中,长期大量使用药物,许多细菌、害虫、植物等出现了抗药性,抗药性在群体中迅速蔓延。请回答下列有关问题:
(1)滥用抗生素往往会导致细菌耐药性的产生。细菌抗药性变异的来源属于_____________。
尽管在细菌菌群中天然存在抗药性基因,但是使用抗生素仍可治疗由细菌引起的感染,原因在于菌群中_____________。细菌耐药性的形成是抗生素对细菌进行_____________的结果,其内在实质是_____________。
在抗生素的作用下,细菌往往只要一到两代就可以得到抗性纯系。而有性生殖的生物,淘汰一个原来频率较低的隐性基因,形成显性纯合子组成的种群过程却需要很多代,原因是_____________。
(2)有些杂草对除草剂也能产生抗药性,这是由于除草剂不能再与由叶绿体中某个发生突变的基因所独立编码的一种与光合作用有关的蛋白质发生特异性的结合,因而不能再影响光合作用的进行。该种抗药性的遗传特点是_____________。
(3)生产上运用化学杀虫剂,常导致害虫再度大爆发,其原因除害虫抗药性增强外,生态学原因还有_____________等。
(4)转基因抗虫棉可以有效地用于棉铃虫的防治。在大田种植转基因抗虫棉的同时,间隔种植少量非转基因的棉花或其他作物,供棉铃虫取食。这种做法的主要目的是( )
A.维持棉田物种多样性 B.减缓棉铃虫基因频率增加的速度
C.使食虫鸟有虫可食 D.维持棉田生态系统中的能量流动
(5)有人认为通过基因工程能培育出理想的抗虫植物,不仅能减轻农药造成的环境污染,而且又能降低生产成本,还有人认为抗虫植物一旦培育成功,其抗虫特性将会连续保持下去,真可谓一劳永逸。对后一种观点,你是否赞成?请说明理由。
答案:(1)基因突变(2分) 有抗药性基因的个体占极少数(抗药性基因频率极低)(2分) 定向选择(2分) 菌群中抗药性基因频率增加(2分) 隐性基因可通过杂合子保存下来(2分)
(2)母系遗传(2分)后代不出现一定的性状分离比(2分)
(3)害虫天敌(或捕食者)大量死亡(2分)
(4)B(2分)
(5)不赞成,因害虫会经过突变和自然选择而产生对抗虫植物的适应性;不赞成,因抗虫植物也会发生变异,而使其后代失去抗虫特性;赞成,因抗虫植物的抗虫特性是由基因控制的,是能够遗传的。(是开放性答案,答出其中一种或其他合理答案均得分)(4分)
解析:生物对某种药物有抗药性是由于该生物有抗药性的变异类型,一旦处于某药的环境中,将有利个体活下来,并且会逐代积累而抗药性增强。最后一问是开放性题目,只要说得合理均可以。
30.(20分)某校高三年级研究性学习小组调查了人的眼皮遗传情况,他们以年级为单位,对统计的数据进行汇总和整理,见下表:
|
|
双亲全为双眼皮(①) |
仅父亲为双眼皮(②) |
仅母亲为双眼皮(③) |
双亲全为单眼皮(④) |
||||
|
性别 |
男 |
女 |
男 |
女 |
男 |
女 |
男 |
女 |
|
双眼皮人数 |
59 |
61 |
31 |
29 |
30 |
30 |
0 |
0 |
|
单眼皮人数 |
38 |
36 |
28 |
28 |
27 |
29 |
56 |
53 |
请分析表中情况,回答下列问题:
(1)根据表中___________组调查情况,你就能判断出显性性状为___________。
(2)根据表中___________组调查情况,能判断人的眼皮遗传是___________染色体遗传。
(3)第①组双亲基因型的所有组合是______________________。
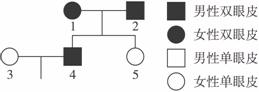
(4)右图是张同学(5号个体)所在家庭的眼皮遗传图谱,请推测张的哥哥(4号)与她嫂子生一个双眼皮孩子的概率是_________________。
(5)表中①的数据为双眼皮∶单眼皮=120∶74,这个统计数据为何与理论上的推论有较大误差?
(6)某单眼皮女生到美容所做了双眼皮,该双眼皮性状能否遗传?为什么?
答案:(1)① 双眼皮(3分)
(2)①② 常(3分)
(3)AA×AA、AA×Aa、Aa×Aa(3分)
(4)2/3(3分)
(5)实际调查的群体较小。(4分)
(6)不能遗传,该女生的遗传物质没有发生改变。(4分)
解析:(1)①中双亲均为双眼皮,而子女中有单眼皮出现,故双眼皮为显性。
(2)①②中子女的眼皮的单双的比例关系为1∶1,与性别无关,因此为常染色体遗传。
(3)双亲均为显性,且有单眼皮出现,因此双亲的基因型为AA×AA、AA×Aa、Aa×Aa。
(4)嫂子的基因型为aa,哥哥的基因型为Aa的概率为2/3,因此他们的孩子是双眼皮的概率为2/3。
(5)由于实际调查的群体较小会影响最终的结果。
(6)做美容是环境引起的变异,是不可遗传的。
29.(15分)葡萄糖是人类的营养素,在人体内富氧条件下氧化生成二氧化碳和水;在缺氧条件下则生成一种有机物A。
已知:
①
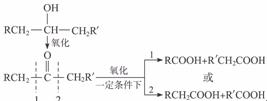
②将A进行下图所示的反应,其中C和C′是同系物,C′是甲酸(HCOOH)
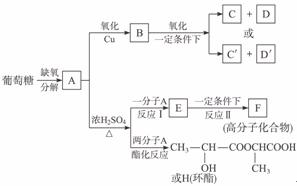
回答下列问题:
(1)C和D′属于____________(填入编号,以下同)
①同系物 ②同分异构体 ③同类物质 ④同素异形体
(2)D′和E分别属于哪一类化合物:D′____________,E____________。
①多元醇 ②醛 ③不饱和羧酸 ④多元羧酸 ⑤酯
(3)写出结构简式:A____________,F____________,H____________。
(4)写出反应类型:反应Ⅰ____________,反应Ⅱ____________。
(5)写出下列转化的化学方程式:
A→E________________________;
A→B________________________。
答案:(1)③(1分)
(2)④(1分) ③(1分)
(3)(各2分,共6分)
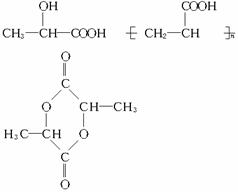
(4)消去反应(1分) 加聚反应(1分)
解析:此题由于A是未知结构,而反应A→B→C+D系列没有具体参考条件,所以本题的分析应从A 系列开始,由
系列开始,由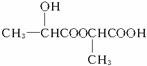 知A的结构为:
知A的结构为: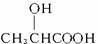 ,所以E为CH2==CH-COOH,F为
,所以E为CH2==CH-COOH,F为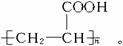
再看A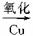 B,可知B为
B,可知B为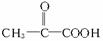 。根据信息:C′是甲酸,则D′就是CH3COOH,C是CH3COOH,D是HCOOH。
。根据信息:C′是甲酸,则D′就是CH3COOH,C是CH3COOH,D是HCOOH。
28.(15分)(1)下列实验操作错误的是( )
A.滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中液面
B.分液时分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.容量瓶检漏的操作:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置,观察是否漏水
D.观察钾元素焰色反应:将铂丝放在稀盐酸中洗涤,然后蘸取固体碳酸钾,置于酒精灯的火焰上进行灼热,透过蓝色钴玻璃进行观察
E.将滴管垂直伸进试管内滴加液体
(2)某中学学习小组在帮助老师整理实验室的化学试剂时,发现一盛有无色溶液的试剂瓶,标签破损(如右图),请你根据已掌握的知识,对该试剂可能是什么物质的溶液作出猜想,并设计实验验证。
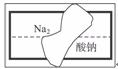
①猜想:这种试剂可能是:_________________________________________________________
②实验验证:_____________________________________________________________________
(1)答案:ACDE(3分)
解析:A项中,左右手的操作正确,但眼睛注视的位置不对,因为终点的确定是准确测定溶液浓度的关键,所以眼睛应注视锥形瓶内液体的颜色变化。C项中,当发现不漏液时,不是反复倒置,而是将活塞旋转180°后再次倒置,若仍不漏液,即说明不漏液。D项中,用稀盐酸洗涤铂丝后,并不是直接用此铂丝粘碳酸钾固体,而是放在酒精灯火焰上燃烧至无色后,再粘上碳酸钾固体。E项中,胶头滴管不能插入试管内,以防试管与试管内壁接触,造成污染。
(2)①从化合价考虑,此盐应为二元酸的正盐,故可能为Na2SO4、Na2CO3、Na2SiO3、Na2SO3等。(6分)
②实验验证的关键是酸根离子的检验。取少量该溶液加入试管中,向其中加入稀盐酸。如果出现白色沉淀,则原溶液是Na2SiO3溶液;若产生无色、无味的气体,则原溶液是Na2CO3溶液;若产生无色、有刺激性气味的气体,则原溶液是Na2SO3溶液;若无明显现象出现,则说明为Na2SO4溶液。(6分)
27.(15分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍;C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X;E与A同主族;A、B、C这三种元素,每一种与D都能形成元素的原子个数比不相同的若干种化合物。
(1)写出下列元素的元素符号:A_____________,E_____________。
(2)D在周期表中位于第_____________周期,第_____________纵行。
(3)B的最高价氧化物的电子式为_____________。
(4)E和D形成的化合物与水反应的化学方程式为_____________。
(5)盐X的水溶液显_____________(填“酸”“碱”或“中”)性,其原因用离子方程式表示是:__________________________。
答案:(1)H Na(3分)
(2)2 16(3分)
(3)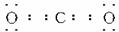 (3分)
(3分)
(4)Na2O+H2O====2NaOH 2Na2O2+2H2O====4NaOH+O2↑(3分)
(5)酸 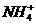 +H2O====NH3·H2O+H+(3分)
+H2O====NH3·H2O+H+(3分)
26.(15分)甲、乙、丙是由短周期元素形成的常见单质,丙在常温下为无色气体,且乙、丙两元素同主族,其余均为常见化合物,它们在一定条件下有如下转化关系(反应中生成的水已?略去):
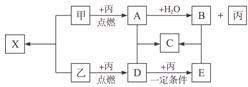
(1)丙的名称是_____________;C的化学式是_____________;X属_____________晶体。
(2)A+D→C的反应属于下列何种反应类型(填序号)_____________。
A.化合反应 B.氧化还原反应
C.非氧化还原反应 D.离子反应
(3)工业生产中,将D转化为E的反应条件是_______________________________________。
(4)写出A与H2O反应的化学方程式:__________________________。
答案:(1)氧气 Na2SO4 离子(6分)
(2)A、B(2分)
(3)400-500 ℃,催化剂(3分)
(4)2Na2O2+2H2O====4NaOH+O2↑(4分)
解析:由甲、乙可在丙中燃烧可知,丙可能为氧气,也可能为氯气,但考虑到丙在常温下为无色气体,确定丙为氧气,从而确定乙为硫。由A与水反应能生成化合物B和氧气可断定,A应为过氧化钠,B为氢氧化钠。再由乙与丙反应,可得出D为二氧化硫,E为三氧化硫,C为硫酸钠,最后可得出X为硫化钠。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com