
题目列表(包括答案和解析)
3.下列表示概念从属关系的图形中,不存在科学性错误的是( )

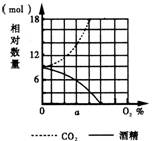
2.现有一瓶混有酵母菌和葡萄糖的培养液,通入不同浓度的氧气,其产生的酒精和CO2的量如图所示。问:在氧气浓度为a时( )
A.酵母菌只进行发酵 B.67%的葡萄糖用于发酵
C.33%的葡萄糖用于发酵 D.酵母菌停止发酵
1.某实验小组为了验证乙烯的生理作用,进行了下列实验:取甲、乙两箱尚未成熟的番茄(绿色),甲箱用一定量的乙烯利(可释放出乙烯)处理;乙箱不加乙烯利作为对照。当发现两箱番茄颜色有差异时,从这两箱中取等量的番茄,分别研磨成匀浆,除去匀浆中的色素,过滤。取无色的等量滤液分别加入甲、乙两支试管中,再各加入等量的斐林试剂,加热后,摇匀观察。下列对该实验过程中出现的实验现象描述错误的是( )
A.甲箱的番茄呈红色 B.乙箱的番茄呈绿色
 C.乙试管中呈砖红色 D.甲试管中也呈砖红色,但比乙试管中的颜色浅
C.乙试管中呈砖红色 D.甲试管中也呈砖红色,但比乙试管中的颜色浅
31.(22分)随着人类生活水平的提高,糖尿病、肥胖症、动脉硬化、高血压、脂肪肝等疾病的发病率有上升趋势。这些疾病的发生与人类营养失衡导致体内营养物质代谢紊乱有密切的联系。下图表示人体细胞三大营养物质代谢的关系,请回答:
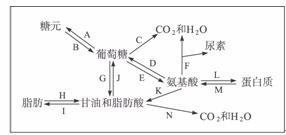
(1)糖尿病病人由于____________分泌不足,导致图中的____________(填序号)过程受到抑制。脂肪分解过程中会产生酮酸,严重时会引起酸中毒,糖尿病病人较易发生酸中毒的原因是________________________。
(2)若图中脂肪在肝脏中积累过多时就会导致人体患____________,其主要原因有____________。
(3)如果人体以蛋白质为主要食物来源时,细胞中多余的氨基酸会发生图中的____________(填序号)过程。
(4)从人体内物质代谢的角度分析形成肥胖的原因____________;减肥应采取的正确的措施是____________。
(5)过剩养分在体内的主要处理途径有哪些?
(6)为什么奶被视为婴儿的理想食品?
(7)指出确定奶内含有蛋白质的一项检验方法,并简述该项检验法的结果。
(8)市场上出售的少数劣质奶粉中掺有植物淀粉,请问用什么方法鉴别?
答案:(1)胰岛素(1分) ACEG 糖氧化分解发生障碍,使体内脂肪分解加强,产生较多的酮酸(2分)
(2)脂肪肝(2分) 肝脏功能不好,或是磷脂等的合成减少,使脂蛋白的合成受阻。脂肪不能顺利从肝脏中运出去,因而造成脂肪在肝脏中堆积所致。(2分)
(3)D、F、K(2分)
(4)摄取的营养物质超过体内消耗的营养物质(营养物质过剩或摄取能量过多)(2分) 减少过多的营养物质的摄入,同时加强锻炼,增加体内的物质消耗(控制饮食、加强锻炼)(2分)
(5)多余的蛋白质通过脱氨基作用形成尿素,通过尿液排出体外;多余的脂肪贮存在皮下、肠系膜等处(2分)
(6)因为奶中含有的三大有机物比例适宜,且有丰富的钙,有利于婴儿生长发育。(2分)
(7)用双缩脲试剂检验,溶液变为红紫色,则说明有蛋白质存在,如不变色,则说明没有蛋白质存在(2分)
(8)用碘液检验,如变蓝则说明有淀粉存在,如不变蓝则说明无淀粉存在。(2分)
解析:糖尿病患者的胰岛素分泌不足,可抑制肝糖元的合成、非糖物质转变成脂肪等、葡萄糖的氧化分解。这样只能多利用脂肪作为能源物,会产生更多的酮酸,从而导致酸中毒。当食物以蛋白质为主时,氨基酸会发生脱氨基,不含N的部分氧化供能。蛋白质的检测用双缩脲试剂,有蛋白质则会出现紫色。检测是否含淀粉用碘液,如含淀粉则会出现蓝色。
30.(20分)有两组纯种小麦品种,一个是高杆抗锈病(DDTT),一个是矮杆不抗锈病(易感病)(ddtt)。现将这两品种进行下列三组实验:

假如以上三组实验都有矮杆抗锈病出现,分析以下问题:
(1)A组所示的育种方法称___________,原理是________________;B组所示的育种方法称_________________,原理是______________________;C组所示的育种方法称____________________,原理是______________________。
(2)A组所得矮抗类型的基因型是___________;B组所得矮抗类型的基因型是___________。
(3)C组获得矮抗是由于发生了基因突变,但一般说来,这种情况不容易发生,因为______________________。
(4)A组F2中的矮抗类型不能直接用作大田栽培,原因是______________________。
(5)B组获得的矮抗类型也不能直接利用,原因是___________,但通过___________处理,可以直接产生理想的矮抗品种,其基因型是___________。
答案:(1)杂交育种(2分) 基因重组(2分)
花药离体培养(2分) 染色体变异(2分) 诱变育种(2分) 基因突变(1分)
(2)ddTT,ddTt(2分) dT(1分)
(3)突变率低,且变异是不定向的(2分)
(4)后代可能会发生性状分离(2分)
(5)单倍体高度不育(2分) 秋水仙素(1分) ddTT(1分)
解析:A组为杂交育种,利用基因重组原理,后代中矮杆抗病基因型为ddTT、ddTt。其中有一种为杂合体。B组为花药离体培养,利用染色体变异,得到的单倍体为dT。要作为种子必须要进行秋水仙素处理。C组为人工诱变育种,利用的是基因突变原理。
29.(14分)M5纤维是美国开发的-种超高性能纤维,在相同的防护级别下,M5纤维比现有的防破片材料轻35%,且防热和防火性能十分出色。据报道,美军士兵佩带的头盔、防弹背心和刚性前后防护板在战争中,保住了许多美军士兵的生命。M5纤维是刚杆形又有强力分子间氢键的聚合物,当z是聚合物主链方向时,在x方向y的氢键是其晶体结构的特征。下面是M5纤维的合成路线:(有些反应未注明条件)
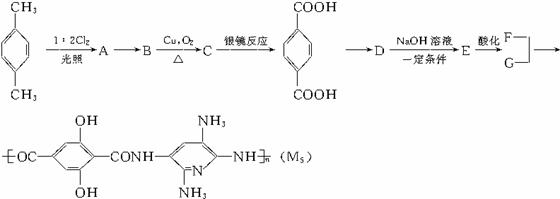
上面合成线路中最后一种物质M5的右半部分的上下两个-NH2。
请完成下列问题:
(1)合成M5的单体的结构简式F__________,G__________。
(2)反应类型:A→B__________,B→C__________。
(3)A的同时可能生成的同分异构体__________。
(4)写出化学反应方程式:C→对苯二甲酸:________________;D→E:__________________。
(5)1 mol的F与NaHCO3溶液反应,最多耗NaHCO3__________mol。
(6)怎样理解M5纤维分子间有氢键?
答案:
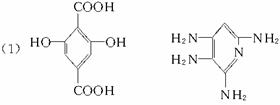 (各2分,共4分)
(各2分,共4分)
(2)取代(水解) 氧化反应(2分)
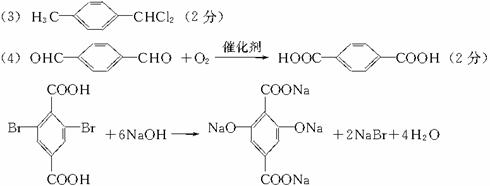
(5)2(2分)
(6)-OH、-NH2等之间均可相互吸引而形成氢键。(2分)
解析:对比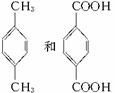 结构和反应流程可知A为
结构和反应流程可知A为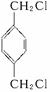 ,B为
,B为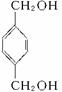 ,C为
,C为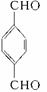 ,再对比
,再对比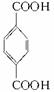 和M5结构可推知D为
和M5结构可推知D为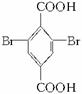 ,E为
,E为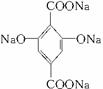 ,F为
,F为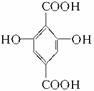 ,G为
,G为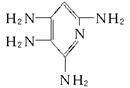
28.(18分)用下图所示装置进行实验,将A逐滴加入B中:
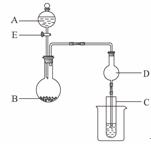
(1)若A为浓H2SO4,B为第三周期金属元素的片状单质,其在常温下难与水反应;C为品红溶液,实验中观察到溶液褪色,则B是____________(填化学式),B与浓H2SO4溶液反应的化学方程式为____________________________________;反应后往烧杯中加入沸水,又可观察到试管C中的现象为________________________。
(2)若B为Na2CO3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是______________________;然后往烧杯中加入沸水,可观察到试管C中的现象是________________。
(3)若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是______________(填名称),C是______________与葡萄糖的混合液,仪器D在此实验中的作用是____________________________。
答案:(1)Mg Mg+2H2SO4(浓)====MgSO4+SO2↑+2H2O 溶液变红(6分)
(2)酸性比碳酸的酸性强 溶液由浑浊变澄清(6分)
(3)氨水(或铵盐的溶液) AgNO3 防止倒吸(6分)
解析:(1)由题意可知,B为第三周期金属元素的片状单质,其在常温下难与水反应,B不是铝就是镁了,但浓硫酸常温下会使铝钝化,所以B只能为镁。(2)根据较强酸的可制取较弱酸的原则,可推断出A的性质。(3)由最后能发生银镜反应知,A为氨水(或铵盐的溶液)。
27.(15分)已知甲、乙、丙是前三周期元素的单质,A、B、C、D、E、F、G、X均为常见化合物;在一定条件下,各物质相互转化关系如下图所示:
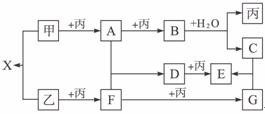
完成下列问题:
(1)写出X的电子式:__________________。
(2)写出B+H2O反应的化学方程式:
____________________________________________________________。
(3)写出X和盐酸反应的化学方程式
_____________________________________________________________。
(4)写出工业生产上由F生成G反应设备名称、____________反应条件__________________。
答案:(1)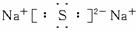 (3分)
(3分)
(2)2Na2O2+2H2O====4NaOH+O2↑(3分)
(3)Na2S+2HCl====2NaCl+H2S↑(3分)
(4)接触室 高温(450 ℃)、常压、催化剂(V2O5)(6分)
解析:此题的突破口之一为“B+H2O→丙+C”,联想我们学过的反应中,化合物与水反应能生成单质的只有Na2O2。从而得出甲为Na,丙为O2,A为Na2O,C为NaOH。另一突破口为A+F→D,F为酸性氧化物,生成的盐D还能再与O2反应,说明其酸根离子还具有还原性,从而确定其为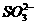 。从而得出乙为S,F为SO2,D为Na2SO3,E为Na2SO4,G为SO3。
。从而得出乙为S,F为SO2,D为Na2SO3,E为Na2SO4,G为SO3。
26.(13分)有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可两两组成甲、乙、丙、丁四种化合物,各化合物中原子个数比关系如下表:
|
|
甲 |
乙 |
丙 |
丁 |
|
化合物中各元素原子个数比 |
A∶C |
B∶A |
D∶E |
B∶E |
|
1∶1 |
1∶2 |
1∶3 |
1∶4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和,B原子最外层电子数比其次外层电子数多2个。在周期表中,C是E的邻族元素,化学性质活泼,D和E则位于同一周期,D和E的原子序数之和为30。
(1)写出元素符号:A___________,B___________,C___________,D___________,E___________。
(2)向甲的水溶液中加入MnO2,反应的化学方程式是____________________________。
(3)已知乙的式量小于甲,在实验室中常用什么方法制得乙:______________________
(4)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会迅速产生大量气体和难溶物,有关离子方程式为______________________。
(5)向3 mL 1 mol·L-1KI溶液中依次注入下列试剂:①1 mL 5 mol·L-1盐酸;②0.5 mL 30%甲溶液;③1 mL丁。经充分振荡后静置,可得到紫色溶液,这种紫色溶液是___________。
答案:(1)H C O Al Cl(5分)
(2)2H2O2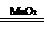 MnO22H2O+O2(2分)
MnO22H2O+O2(2分)
(3)CH3CH2OH CH2====CH2↑+H2O(2分)
CH2====CH2↑+H2O(2分)
(4)Al3++3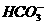 ====Al(OH)3↓+3CO2↑(2分)
====Al(OH)3↓+3CO2↑(2分)
(5)I2的CCl4溶液(2分)
解析:从题干我们可以推出甲为H2O2,但若从题肢(2)分析,更容易得出甲为H2O2,从而得出A为H,C为O。由“B原子最外层电子数比其次外层电子数多2个”,不难得出B为碳。由B、E形成的化合物为BE4,可得出E的化合价为-1价,由D的化合价为+3价,再根据二者的原子序数和为30,即可得出D为Al,E为Cl。
25.(20分)如图所示,两个几何形状完全相同的平行板电容器PQ和MN,水平置于水平方向的匀强磁场中,磁场方向垂直纸面向里(磁场区域足够大),两电容器极板左端和右端分别在同一竖直线上。已知P、Q之间和M、N之间的距离都是d,板间电压都是U,极板长度均为l。今有一电子从极板边缘的O点以速度v0沿P、Q两板间的中心线进入电容器,并做匀速直线运动穿过电容器,此后经过磁场偏转又沿水平方向进入到电容器M、N板间,在电容器M、N中也沿水平方向做匀速直线运动,穿过M、N板间的电场后,再经过磁场偏转又通过O点沿水平方向进入电容器P、Q极板间,循环往复。已知电子质量为m,电荷为e。
(1)试分析极板P、Q、M、N各带什么电荷;
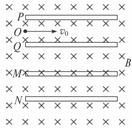
(2)Q板和M板间的距离x满足什么条件时,能够达到题述过程的要求?
(3)电子从O点出发至第一次返回到O点经过了多长时间?
答案:(1)根据题意分析:电子在P、Q两板间从左向右运动,由左手定则可判断出,电子所受洛伦兹力方向竖直向下,因为电子要做匀速直线运动,故所受电场力方向必须竖直向上,由于电子带负电,所以P极板带正电、Q极板带负电,同理可知,电子在M、N板间运动过程中,受洛伦兹力方向竖直向上,电场力方向必须竖直向下,故M板带负电,N板带正电。(6分)
(2)因为粒子在电容器的两极板间做匀速直线运动,所以受到的洛伦兹力与电场力大小相等,因此有:ev0B=eU/d,(2分)当电子射出电容器后在磁场中做匀速圆周运动,设圆周半径为R,根据洛伦兹力公式和向心力公式有ev0B=mv02/R,(2分)要使电子能进入M、N板间,则应满足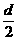 +x<2R<
+x<2R<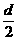 +x+d,(2分)解得:
+x+d,(2分)解得: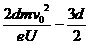 <x<
<x<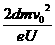 -
-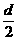 。(2分)
。(2分)
(3)因为电子在电容器的两极板间是做匀速直线运动,所以电子通过一个电容器的时间t1=l/v0,(2分)设电子在磁场中做圆周运动的周期为T,由洛伦兹力提供向力得:F心=f=qvB=m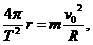 R=
R=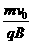 ,(2分)再根据ev0B=eU/d得:B=
,(2分)再根据ev0B=eU/d得:B=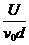 ,(2分)电子在磁场中运动半个圆周的时间:t2=T/2=
,(2分)电子在磁场中运动半个圆周的时间:t2=T/2=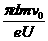 ,(2分)所以电子第一次返回到O点的时间:t=2(t1+t2)=2(
,(2分)所以电子第一次返回到O点的时间:t=2(t1+t2)=2(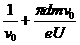 )。(2分)
)。(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com