
题目列表(包括答案和解析)
3.水稻(基因型为AaBb)的花药通过无菌操作,接入试管,经过如下过程培育试管苗。以下选项中正确的是
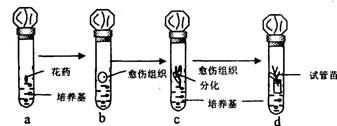
A.a:用花药离体培养法获得单倍体植株;b:通过有丝分裂产生愈伤组织;c:培养基中至少应有乙烯和脱落酸;d:试管苗的生长发育不需要光照
B.a:用花药离体培养法获得二倍体植株;b:通过减数分裂产生愈伤组织;c:培养基中至少应有生长素和细胞分裂素;d:试管苗的生长发育不需光照
C.a:用花药离体培养法获得单倍体植株;b:通过有丝分裂产生愈伤组织;c:培养基中至少应有生长素和细胞分裂素;d:试管苗的生长发育需要光照
D.a:用花药离体培养法获得二倍体植株;b:通过有丝分裂产生愈伤组织;c:培养基中至少应有乙烯和脱落酸;d:试管苗的生长发育需要光照
2.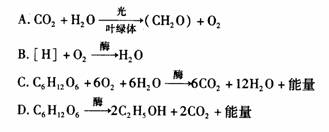 用含有15N标记胸腺嘧啶脱氧核苷酸的营养液培养根尖分生区细胞,一段时间后分离获得具有放射性的细胞器。可在这类细胞器内完全进行的生理过程是
用含有15N标记胸腺嘧啶脱氧核苷酸的营养液培养根尖分生区细胞,一段时间后分离获得具有放射性的细胞器。可在这类细胞器内完全进行的生理过程是
1.下列关于矿质元素吸收、运输和利用的叙述,不正确的是
A.矿质元素的吸收主要在根尖成熟区的表皮细胞
B.矿质元素吸收受到土壤温度、通气状况和含水量等因素的影响
C.植物蒸腾作用为矿物质元素的吸收和运输提供动力
D.移栽到缺镁培养液中培养的植株,其顶部叶片仍然会保持绿色
31.(10分)
为扩大可耕地面积,增加粮食产量,黄河三角洲等盐碱地的开发利用备受关注。我国科学家应用耐盐基因培育出了耐盐水稻新品系。
(1)由导入目的基因的水稻细胞培养成植株需要利用 技术。该技术的
核心是 和 。
(2)为了确定耐盐转基因水稻是否培育成功,既要用放射性同位素标记的 作探针进行分子杂交检测,又要用 方法从个体水平鉴定水稻植株的耐盐性。
30.(18分)
某自花传粉植物的紫苗(A)对绿苗(a)为显性,紧穗(B)对松穗(b)为显性,黄种皮(D)对白种皮(d)为显性,各由一对等位基因控制。假设这三对基因是自由组合的。现以绿苗紧穗白种皮的纯合品种作母本,以紫苗松穗黄种皮的纯合品种作父本进行杂交实验,结果F1表现为紫苗紧穗黄种皮。
请回答:
(1)如果生产上要求长出的植株一致表现为紫苗紧穗黄种皮,那么播种F1植株所结的全部种子后,长出的全部植株是否都表现为紫苗紧穗黄种皮? ,为什么? 。
(2)如果需要选育绿苗松穗白种皮的品种,那么能否从播种F1植株所结种子长出的植株中选到? ,为什么? 。
(3)如果只考虑穗型和种皮色这两对性状,请写出F2代的表现型及其比例。 。
(4)如果杂交失败,导致自花受粉,则子代植株的表现型为 ,基因型为 ;如果杂交正常,但亲本发生基因突变,导致F1植株群体中出现个别紫苗松穗黄种皮的植株,该植株最可能的基因型为 。发生基因突变的亲本是 本。
29.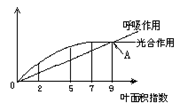 (22分,除说明外,每空2分)
(22分,除说明外,每空2分)
Ⅰ(4分,每空1分)右图表示小麦种子在暗处萌发并生长时释放的 CO2量变化,在此环境中约20天左右幼苗死亡。请根据曲线图回答有关问题:
(1)上述种子萌发的幼苗与自然条件下萌发生长的幼苗相比,缺少的生命活动是___ ___ _。
(2)在种子萌发初期CO2释放量较少的原因是__________________________________________________________________________。
(3)在种于萌发6天内CO2释放量逐渐增加的原因是_ ______。
(4)一周后种子萌发释放的CO2量逐渐下降的原因是_______________________________________。
Ⅱ(18分)为了研究胰腺分泌胰液的调节机理,某学校生物兴趣小组的同学们从实验狗甲的一段小肠壁上刮下黏膜,将该黏膜放入稀盐酸中浸泡,把过滤后的提取液注入实验狗乙的静脉,结果引起实验狗乙的胰液大量分泌,并由此得出“小肠黏膜中存在促进胰液分泌的某种物质”的结构。分析这一实验设计,回答下列问题:
(1)该实验的实验假设是___________________ __。
(2)仅根据上述实验设计,能得出题干中的实验结论吗? 为什么?_____________ ___。
(3)试完善该实验的步骤设计。
同时将_________________注射到狗乙特征相同的狗丙的静脉,观察________________________________________________。
(4)预测可能的实验结果,并获得相应的实验结论。
①_________________________________________________________________。
② 。
28.(15分)化学选考题
A.(物质结构与性质)
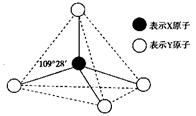 由短周期元素组成的A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有
由短周期元素组成的A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有
如图所示的结构或结构单元,(图中正四面体以外可能有的部分未画出,虚线不表示化
学键或分子间作用力,X、Y可以相同也可以不同)。A、B的晶体类型相同。单质A的
同素异形体能与B物质发生置换反应。C、D、E、F含有相等的电子数,且D是阳离子,
D与F的组成元素相同。C、E、F的晶体类型相同,由E构成的物质常温下呈液态。
(1)写出单质A的同素异形体与B物质发生置换反应的化学方程式_______________;
与A同主族的第四周期元素基态原子的电子排布式为________________。
(2)上述六种物质或粒子的组成元素中有三种处于同一周期,请写出这三种元素第一电
离能由大到小的顺序______________(用元素符号回答)。
(3)上述六种物质或粒子中互为等电子体的是_________________(写化学式)。
(4)F分子的电子式为___________,中心原子杂化类型是__________,F易溶于E,其
原因是_______________________________________。
B.(有机化学)
咖啡酸(下式中的A)是某种抗氧化剂成分之一,A结构中苯环上有3个取代基,且取
代基中不含支链,A遇FeCl3溶液发生显色反应。A有如下转化关系:

(1)咖啡酸A中含氧官能团名称为_____________;
(2)写出A生成D的化学反应方程式:______________________________________,该
反应的反应类型为___________________。
(3)a mol咖啡酸A与足量钠反应生成气体(标准状况)_______L。
(4)蜂胶的主要成分(分子式为C17H16O4)是由咖啡酸A和一种芳香醇E发生酯化反应
生成的,已知E的芳香醇类同分异物体有5种,其中三种为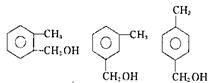
请写出另外两种_________________________________________。
27.(16分)食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流
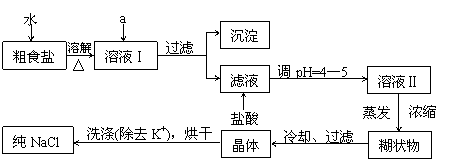
 程如下:
程如下:
提供的试剂:饱和Na2CO3溶液,饱和K2CO3溶液,NaOH溶液,BaCl2溶液,Ba(NO3)2
溶液,75%乙醇,四氯化碳
① 欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次
为____________________________(只填化学式)。
② 洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________________________。
(2)用提纯的NaCl配制500mL 4.00 mol·L-1的NaCl溶液,所用仪器除药匙、玻璃棒外
|
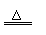
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2____
____(填“>”“=”或“<”)2L,原因是______________________________________。
装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法
为_____________________________。
 (4)实验室制备H2和Cl2通常采用下列反应Zn + H2SO4 ZnSO4 + H2↑;
(4)实验室制备H2和Cl2通常采用下列反应Zn + H2SO4 ZnSO4 + H2↑;
MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O,据此,从下列所给仪器装置中选择制
备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置________
(填代号)。
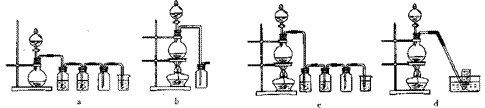 可选用制备气体的装置:
可选用制备气体的装置:
26.(12分)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯
(C3H6)。(1)丙烷脱氢可得丙烯。
 已知:C3H8 (g) CH4(g) + HC≡CH(g) + H2(g)
已知:C3H8 (g) CH4(g) + HC≡CH(g) + H2(g) H1= +156.6 kJ·mol-1
H1= +156.6 kJ·mol-1
 CH3CH=CH2(g) CH4(g) + HC≡CH(g)
CH3CH=CH2(g) CH4(g) + HC≡CH(g) H2= +32.4 kJ·mol-1
H2= +32.4 kJ·mol-1
 则相同条件下,反应C3H8(g) CH3CH=CH2(g)
+ H2(g)的
则相同条件下,反应C3H8(g) CH3CH=CH2(g)
+ H2(g)的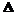 H=_______kJ·mol-1
H=_______kJ·mol-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解
质是熔融碳酸盐。电池反应方程式为__________________________________;放电
时,CO32-移向电池的_______(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平
衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的
 第二级电离,则H2CO3 HCO3-
+ H+的平衡常数K1=_________。
第二级电离,则H2CO3 HCO3-
+ H+的平衡常数K1=_________。
(已知:10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1 NaHCO3溶液的pH大于8,则溶液中c(H2CO3)______c(CO32-)
(填“>”“=”或“<”),原因是_______________________________________________
(用离子方程式和必要的文字说明)。
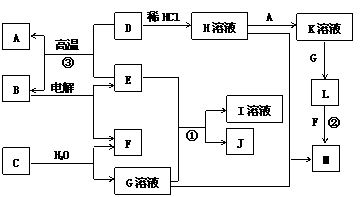
25.(15分)以下框图中A-M是中学化学常见的物质,其中A、E是金属,F和J为气体单
质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体。
 请回答下列问题:
请回答下列问题:
(1)写出B的化学式_________;指出C物质中所包含的化学键类型__________________。
(2)若将H溶液加热蒸干、灼烧,最终得到的固体物质的化学式___________。
(3)写出①反应的离子方程式__________________________________。
(4)写出②、③反应的化学方程式_______________________________________;
___________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com