
题目列表(包括答案和解析)
(二)材料用具:大鼠若干只;普通饲料;三种不同剂量的三聚氰胺溶液A、B、C(分别为低、中、高浓度);其他所需条件均满足(如何检测肾部是否有结石不做要求;为了统一评价,检测结果只以大鼠肾部结石的发生率做为指标)。
(一)实验题目:探究三聚氰胺是否可能造成动物肾部结石。
13.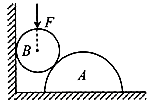 在粗糙水平地面上与墙平行放着一个截面为半圆的柱状物体A, A与竖直墙之间放一光滑圆球B,整个装置处于静止状态。现对B加一竖直向下的力F,F的作用线通过球心,设墙对B的作用力为F1,B对A的作用力为F2,地面对A的作用力为F3。若F缓慢增大而整个装置仍保持静止,截面如图所示,在此过程中
在粗糙水平地面上与墙平行放着一个截面为半圆的柱状物体A, A与竖直墙之间放一光滑圆球B,整个装置处于静止状态。现对B加一竖直向下的力F,F的作用线通过球心,设墙对B的作用力为F1,B对A的作用力为F2,地面对A的作用力为F3。若F缓慢增大而整个装置仍保持静止,截面如图所示,在此过程中
A. F1保持不变,F3缓慢增大 B. F1缓慢变大,F3保持不变 C. F2缓慢增大,F3缓慢增大 D. F2缓慢增大,F3保持不变
14.据媒体报道,嫦娥一号卫星环月工作轨道为圆轨道,轨道高度200 km,运动周期127分钟。若还知道引力常量和月球平均半径,仅利用以上条件能求出的是
A.月球表面的重力加速度 B.月球对卫星的吸引力
C.卫星绕月球运行的速度 D.卫星绕月运行的加速度
15.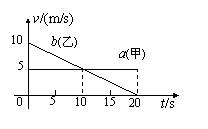 甲乙两辆汽车在平直的公路上沿同一方向作直线运动,t=0时刻同时经过公路旁的同一个路标。在描述两车运动的v-t图中(如图),直线a、b分别描述了甲乙两车在0-20 s的运动情况。关于两车之间的位置关系,下列说法正确的是
甲乙两辆汽车在平直的公路上沿同一方向作直线运动,t=0时刻同时经过公路旁的同一个路标。在描述两车运动的v-t图中(如图),直线a、b分别描述了甲乙两车在0-20 s的运动情况。关于两车之间的位置关系,下列说法正确的是
A.在0-10 s内两车逐渐远离
B.在10-20 s内两车逐渐远离
C.在5-15 s内两车的位移相等
D.在t=10 s时两车在公路上相遇
16.电阻R1、R2交流电源按照图1所示方式连接,R1=10 ,R2=20
,R2=20 。合上开关后S后,通过电阻R2的正弦交变电流i随时间t变化的情况如图2所示。则
。合上开关后S后,通过电阻R2的正弦交变电流i随时间t变化的情况如图2所示。则
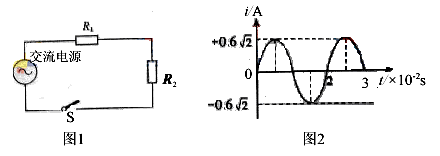
A、通过R1的电流的有效值是1.2A B、R1两端的电压有效值是6V
C、通过R2的电流的有效值是1.2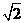 A D、R2两端的电压有效值是6
A D、R2两端的电压有效值是6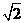 V
V
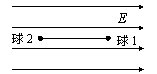
17、两个质量相同的小球用不可伸长的细线连结,置于场强为E的匀强电场中,小球1和小球2均带正电,电量分别为q1和q2(q1>q2)。将细线拉直并使之与电场方向平行,如图所示。若将两小球同时从静止状态释放,则释放后细线中的张力T为(不计重力及两小球间的库仑力)
 A.
A.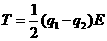 B.
B.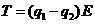
C.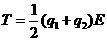 D.
D.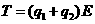
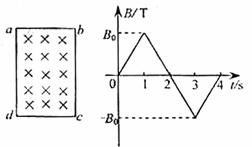
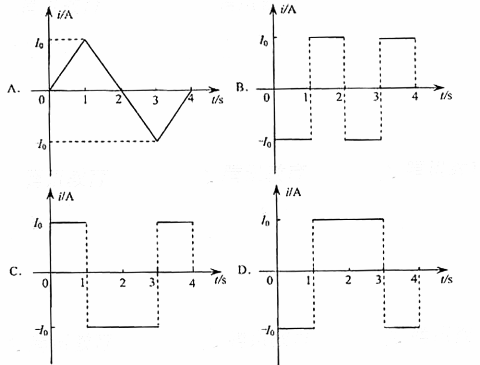
18.矩形导线框abcd固定在匀强磁场中,磁感线的方向与导线框所在平面垂直,规定磁场的正方向垂直低面向里,磁感应强度B随时间变化的规律如图所示.若规定顺时针方向为感应电流I的正方向,下列各图中正确的是
第Ⅱ卷
必考部分
第Ⅱ卷必考部分共9题,共157分。
19.(18分)
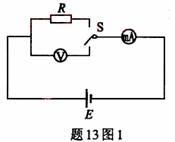 (ⅰ)(9分)图1中电源电动势为E,内阻可忽略不计;电流表
(ⅰ)(9分)图1中电源电动势为E,内阻可忽略不计;电流表 具有一定的内阻,电压表
具有一定的内阻,电压表 的内阻不是无限大,S为单刀双掷开关,R为待测电阻。当S向电压表一侧闭合时,电压表读数为U1,电流表读数为I1;当S向R一侧闭合时,电流表读数为I2。
的内阻不是无限大,S为单刀双掷开关,R为待测电阻。当S向电压表一侧闭合时,电压表读数为U1,电流表读数为I1;当S向R一侧闭合时,电流表读数为I2。
(1)根据已知条件与测量数据,可以得出待测电阻
R=______________。
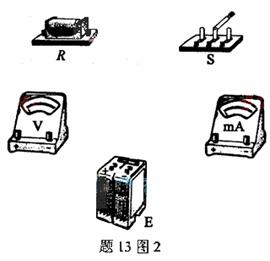
(2)根据图1所给出的电路,在图2的各器件实物图之间画出连接的导线。
 (ⅱ) (9分)现要验证“当质量一定时,物体运动的加速度与它所受的合外力成正比”这一物理规律。给定的器材如下:一倾角可以调节的长斜面(如图)、小车、计时器一个、米尺。
(ⅱ) (9分)现要验证“当质量一定时,物体运动的加速度与它所受的合外力成正比”这一物理规律。给定的器材如下:一倾角可以调节的长斜面(如图)、小车、计时器一个、米尺。
(1)填入适当的公式或文字,完善以下实验步骤(不考虑摩擦力的影响):
① 小车自斜面上方一固定点A1从静止开始下滑至斜面底端A2,记下所用的时间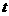
② 用米尺测量A1与A2之间的距离s,则小车的加速度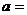 ____________。
____________。
③ 用米尺测A1相对于A2的高h 。设小车所受重力为mg,则小车所受的合外力F=________。④ 改变_________________,使A1与A2之间的距离s不变,重复上述测量。
⑤ 以h为横坐标,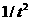 为纵坐标,根据实验数据作用作图。如能得到一条过原点的直线,则可以验证“当质量一定时,物体运动的加速度与它所受的合外力成正比”这一规律。
为纵坐标,根据实验数据作用作图。如能得到一条过原点的直线,则可以验证“当质量一定时,物体运动的加速度与它所受的合外力成正比”这一规律。
(2)若考虑摩擦力的影响,还能用以上实验装置与步骤,验证“当质量一定时,物体运动的加速度与它所受的合外力成正比”这一物理规律?
你的意见是________。(填“能”或“不能”)
20.(17分)如图所示,物体从光滑斜面上的A点由静止开始下滑,经过B点后进入水平面(设经过B点前后速度大小不变),最后停在C点。每隔0.2秒钟通过速度传感器测量物体的瞬时速度,下表给出了部分测量数据。(重力加速度g=10m/s2)
求:


(1)斜面的倾角a;
(2)物体与水平面之间的动摩擦因数m;0
(3)物体在斜面上运动的时间;
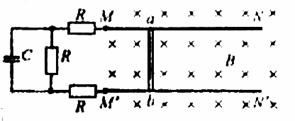
21.(18分)两根光滑的长直金属导轨导轨MN、M'N'平行置于同一水平面内,导轨间距为l,电阻不计,M、M'处接有如图所示的电路,电路中各电阻的阻值均为R,电容器的电容为C。长度也为l、阻值同为R的金属棒ab垂直于导轨放置,导轨处于磁感应强度为B、方向竖直向下的匀强磁场中。ab在外力作用下向右匀速运动且与导轨保持良好接触,在ab运动距离为s的过程中,整个回路中产生的焦耳热为Q。求:
(1)ab运动速度v的大小;(2)电容器所带的电荷量q. 郝双老师制作
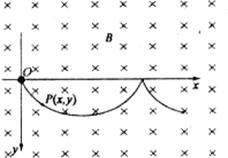
22.(19分)在场强为B的水平匀强磁场中,一质量为m、带正电q的小球在O点静止释放,小球的运动曲线如图所示.已知此曲线在最低点的曲率半径为该点到x轴距离的2倍,重力加速度为g.求:
(1)小球运动到任意位置P(x,y)处的速率v.
(2)小球在运动过程中第一次下降的最大距离ym.
 (3)当在上述磁场中加一竖直向上场强为E(
(3)当在上述磁场中加一竖直向上场强为E(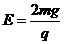 )的匀强电场时,小球从O静止释放后获得的最大速率vm.
)的匀强电场时,小球从O静止释放后获得的最大速率vm.
23.(12分)现有aA、bB、cC、dD、eE、fF六种短周期元素,原子序数依次增大,A、B、C、D都是生命不可缺少的重要元素。已知它们原子序数存在如下关系:a+b=c, a+c=d, b+c=f;元素A、B、C和D都能形成原子个数比为1:1和1:2的化合物;元素E的原子是短周期主族元素中原子半径最大的原子。其中由A、B、D三元素组成的化合物甲,其化学式灾BA4D;由D、E两元素形成原子个数比为1:1化合物乙;C的气态氢化物和最高价氧化物的水化物分别为丙和丁。请根据要求回答下列问题:
(1)经测定,A2D2的水溶液呈弱酸性。请写出第一步的电离方程式 。
(2)用甲和单质D2可设计成燃料电池,若电解质溶液为浓KOH溶液,则正极反应式为 .
(3)3.9g乙与足量的水反应,电子转移的物质的量是 。
(4)单质F与E的最高价氧化物的水化物的溶液反应的离子方程式是 。
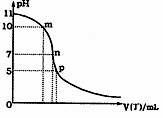 (5)常温下向25mL 0.1mol·L-1丙溶液中逐滴滴加0.1mol·L-1丁溶液,滴加过程中混合溶液pH的变化曲线如右图所示:
①图中m点由水电离也的OH-的物质的量浓度为
;
②p点时,丙溶液和丁溶液恰好完全反应,则p点溶液中各种离子浓度由大到小的顺序为 。
24.(16分)下面是某化学课外活动小组研究浓硫酸的氧化性的结论并进行了实验验证:
(5)常温下向25mL 0.1mol·L-1丙溶液中逐滴滴加0.1mol·L-1丁溶液,滴加过程中混合溶液pH的变化曲线如右图所示:
①图中m点由水电离也的OH-的物质的量浓度为
;
②p点时,丙溶液和丁溶液恰好完全反应,则p点溶液中各种离子浓度由大到小的顺序为 。
24.(16分)下面是某化学课外活动小组研究浓硫酸的氧化性的结论并进行了实验验证:
①一般认为1:1的硫酸浓度大于60%,就具有一定的强氧化性,越浓氧化性越强,60%以下的H2SO4氧化性就不怎么强了。
②温度也影响氧化性,如铜放于冷的浓硫酸中反应不明显,如果加热就可以观察到明显现象。
③98%的浓硫酸物质的量浓度为18.4mol·L-1,密度为1.84g·cm-3
据以上信息回答:
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3mL水,然后从分液漏斗中加98%的浓硫酸0.5mL,加热至沸腾,该试管中液体没有明显变化,试用数据解释原因 。
(2)甲同学再用分液漏斗加浓硫酸10mL再加热至沸腾,现象是_______________。写出与过程有关的化学方程式_______________。
(3)乙同学利用所示装置直接从分液漏斗中再加浓硫酸10mL与铜片反应。所观察到与甲不同的现象除了观察到有黑色物质出现外,还有①______ _______________,原因是_____________;②______ ____________,原因是_______________________。为了最终看到与甲类似的现象,乙同学需进行的操作是_____________________________。
25.(17分)氨是一种重要的化工原料,氨的的合成和应用是当前的重要研究内容之一。
(1)传统哈伯法合成氨工艺中,N2+3H2
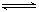 2NH3 △H<0
2NH3 △H<0
①该反应的平衡常数K的表达式为:K=______。升高温度,K值 (填“增大”、“减小”或“不变”)。
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(2和H2的起始物质的量之比为1∶3 ) 。分析表中数据, ℃ MPa时H2转化率最高,实际工业生产不选用该条件的主要原因是 。
③下列关于合成氨说法正确是 。(填字母)
A.使用催化剂可以提高NH3的产率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0,△S>0,故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3+3O2═2N2+6H2O。写出负极电极反应式 ,你认为电解质溶液应显 性(填“酸性”、“中性”、“碱性”),其原因是 。
26.(28分)细胞是生物体结构和功能的基本单位,也是新陈代谢的主要场所。图中的A、B、C、D是4种不同类型的细胞,请据图回答下列问题:
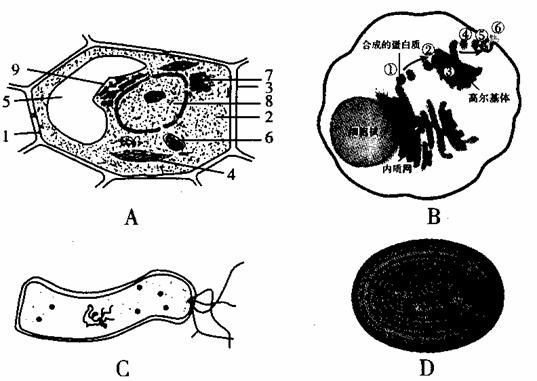
⑴A-D图中,图 是幽门螺杆菌结构模式图,其区别于酵母菌的最主要的结构特点是 。
⑵A-D图所示细胞中一定能进行光合作用的是 (填代号)。
⑶与B细胞相比,A细胞中特有的能产生ATP的结构是[ ] 。
⑷B细胞的某种分泌蛋白,在核糖体中合成之后,按照 (用箭头和结构名称表示)的方向运到细胞外。
⑸图A中[4]和[6]两种具有膜结构的细胞器为适应各自的功能,都有增大膜面积的方式,它们分别是 。
⑹研究图B细胞生命活动过程,一般采用的研究方法是 。
⑺若图B细胞表示动物胰脏内的细胞,⑥可能为 。
⑻从图B中可看出,通过形成囊泡形式相互转化的生物膜是 。
⑼若B图示鼠的效应B淋巴细胞,则它是否具有增殖能力? ,为什么? 如果不能,一般采用什么方法让其恢复增殖能力? ;
⑽若B图示为癌细胞,则明显增多的细胞器有 等(要求填写两个)。癌细胞容易在有机体内分散和转移的原因是 。
27.(12分 )三聚氰胺外形为“白色单斜晶体”、“无味”,形似蛋白粉,其含氮量高,如果仅凭含氮量多少来确定蛋白质含量的多少,那么三聚氰胺完全可以假乱真。由此,价廉且容易获得的三聚氰胺便可以堂而皇之地代替了真正的蛋白质而混入婴幼儿食用的配方奶粉之中。然而,三聚氰胺本身几乎没有任何营养价值,添加之后,只能造成蛋白质含量提高的假象,奶粉当中的营养物质含量必然大大低于正常值。更可怕的是,三聚氰胺具有轻微毒性,其危害并不为人所熟知。1945年的一个实验报道,动物长期摄入三聚氰胺会造成生殖、泌尿系统的损害,膀胱、肾部结石,并可进一步诱发膀胱癌。
为了解三聚氰胺的危害,生物兴趣小组想利用以下材料,设计实验探究三聚氰胺是否可能造成动物肾部结石,请你为他们完成下列实验设计和预测实验结果并分析。
12.将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是…………………………………………( )
A.最终无沉淀生成 B.反应过程中得到6.72L(标准状况)的气体
C.最终得到的溶液中c(NaCl)=1.5mo/L D.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
11.下列两种溶液等体积混合后,混合液中微粒的物质的量浓度关系正确的是( )
A.pH=3的盐酸和pH=3的醋酸溶液:c(Cl-)=c(CH3COO-) B.pH=3的盐酸和pH=11的氨水:c(OH-)>c(H+) C.0.1 mol•L-1的NaOH溶液与0.1 mol•L-1的醋酸溶液:c(Na+)<c(CH3COO-) D.0.1mol•L-1的NH4Cl溶液和0.1mol•L-1的NH3•H2O溶液(混合后呈碱性):
c(NH4+)<c(Cl-)
10.根据表1信息,判断以下叙述正确的是…………………………………………( )
表1 部分短周期元素的原子半径及主要化合价
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
9.下列离子方程式中正确的是………………………………………… ( )
A.少量的NaHSO4与Ba(OH) 2溶液反应:Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O
B.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
C.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2 = 2Fe3++Br2+4Cl-
D.苯酚钠溶液中通入少量: -O-+CO2+H2O→
-O-+CO2+H2O→ -OH+HCO3-
-OH+HCO3-
8.下列各项中的两个量,其比值一定为2:1的是……………………………………( )
A.在Na2O2晶体中阳离子与阴离子的物质量之比
B.22.4LCO2与22.4L CO所含氧原子数目之比
C.相同温度下,0.2mol·L-1醋酸溶液与0.1mol·L-1醋酸中的c(H+ )之比
D.液面均在“0”刻度时,50ml碱式滴定管和25ml碱式滴定管所盛溶液的体积之比
7.下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是:①向饱和碳酸钠溶液中通入过量的CO2;②向Fe(OH)3胶体中逐滴加入过量的稀硫酸;③向AgNO3溶液中逐滴加入过量氨水;④向硅酸钠溶液中逐滴加入过量的盐酸………………………………………… ( )
A.①② B.①④ C.①③ D.②③
6.据悉,北京奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学方程式为:5KClO3 + 6P=3P2O5 + 5KCl ,则下列有关叙述错误的是………………………………………………( )
A.上述反应中的生成物P2O5是酸性氧化物
B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
C.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
D.上述反应中消耗3molP时,转移电子的物质的量为15mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com