
题目列表(包括答案和解析)
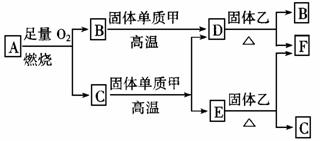
回答下列问题:
(1)若气体A中,X与Y的质量比小于3,则气体A中肯定有(写化学式)______。
(2)若气体A为单一气体,且分子是直线型结构。又知X与Y两元素的质量比数值上等 于X的相对原子质量。A分子的电子式为__________。
(3)C与固体单质甲在高温下发生反应的化学方程_________________________。固体乙为常见化合物,写出一种固体乙的化学式____________________。
27.(18分) 三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
(1)若假设1成立,则实验现象是 。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 简述你的理由(不需写出反应的方程式 )
。
(3)若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是 ,写出发生反应的离子方程式
。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg( b > a),则混合物中Cu2O的质量分数为 。
(5)实验小组欲利用该红色粉末制取较纯净的胆矶 (CuS04 . 5H20) °经查阅资料得知 ,
在溶液中通过调节溶液的酸碱性而使Cu2 +、Fe2+、Fe3+分别生成沉淀的pH 如下:
|
物质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
开始沉淀pH |
6.0 |
7.5 |
1.4 |
|
沉淀完全pH |
13 |
14 |
3.7 |
实验室有下列试剂可供选择:A. 氯水 B. H2O2 C. NaOH D. Cu2(OH)2CO3
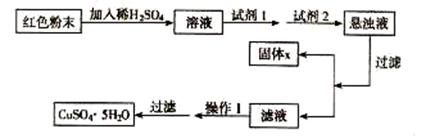 实验小组设计如下实验方案:
实验小组设计如下实验方案:
试回答:
① 试剂I为 ,试剂II为 (填字母)。
② 固体X的化学式为 。
③ 操作I为 。
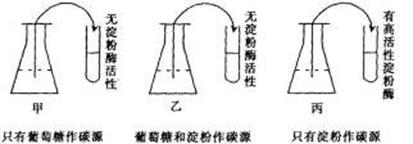
(1)所培养细菌的代谢类型为 。
(2)在该细菌酶合成的调节中,淀粉酶属于 酶,合成此酶需要的特殊细胞内、外条件分别是 和
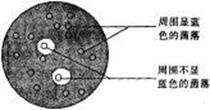 (3)经过诱变处理,在无淀粉条件下培养该菌,也从培养液中检测出了高活性淀粉酶,将诱变后得到的菌悬液适当稀释后,转接于同时含有葡萄糖和淀粉作碳源的固体培养基上培养,得到若干菌落后用碘液作显色处理,看到如下图所示情况,这说明__________的菌落是突变菌,突变率约____%(小数点后一位)。此变异应该发生在控制淀粉酶合成的_____结构的(填“编码区”或“非编码区”)。
(3)经过诱变处理,在无淀粉条件下培养该菌,也从培养液中检测出了高活性淀粉酶,将诱变后得到的菌悬液适当稀释后,转接于同时含有葡萄糖和淀粉作碳源的固体培养基上培养,得到若干菌落后用碘液作显色处理,看到如下图所示情况,这说明__________的菌落是突变菌,突变率约____%(小数点后一位)。此变异应该发生在控制淀粉酶合成的_____结构的(填“编码区”或“非编码区”)。
31.(一)(8分)“绿色”的含义除了包括城市绿化、绿色生活方式与消费理念外,还应包括尊重自然、珍惜生命,追求天人合一的生态伦理道德等。“绿色城市”需要从我做起,从身边的小事做事。
(1)近年来城市的绿地总面积和人均绿地面积在逐年上升。你认为大量引进非本地树种、草种,可能会产生的后果是 。保护生物多样性应在 、 、 三个层次上采取保护战略和保护措施。
(2)垃圾实在是被人们放错了地方的资源,实现垃圾的“减量化、资源化和无害化”是绿色城市的重要标志之一。下图是垃圾资源化、无害处理的一种方案,此方案中①、②过程需要每一位市民的参与,具体做法是 。
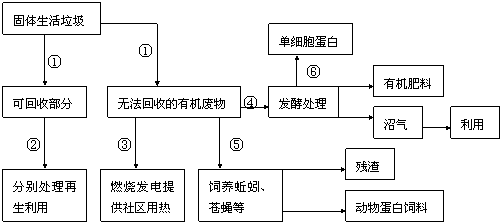
④、⑤过程利用生物的属于生态系统的何种成分? 。从对资源的充分利用角度看,④、⑤途径优于③途径的原因是 。
(3)下表是五个种群在一个相对稳定的水域生态系统中所含有的总能量和污染物X的平均浓度。
已知水中X的质量浓度为0.003mg/L,请分析说明:
|
|
甲 |
乙 |
丙 |
丁 |
戊 |
|
能量(kJ) |
1.6×109 |
1.2×109 |
1.3×108 |
9.1×107 |
2.9×107 |
|
X含量(mg/L) |
0.037 |
0.036 |
0.35 |
0.39 |
3.4 |
若每一种生物都可被相邻的下一个营养级的所有生物捕食,请绘出这个生态系统最简单的营养结构。
24.(18分) (1)L=v0t, 2分 L==, 2分
所以E=, qEL=Ekt-Ek, 2分 所以Ekt=qEL+Ek=5Ek, 2分
(2)若粒子由bc边离开电场,
L=v0t, 1分
vy==, 1分
Ek’-Ek=mvy2==, 2分
所以E=, 2分
若粒子由cd边离开电场,
qEL=Ek’-Ek, 2分
所以E=。 2分
 25(20分) (1)驱动电机的输入功率
25(20分) (1)驱动电机的输入功率 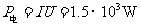 4分
4分
(2)在匀速行驶时 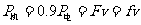 4分
4分
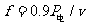
汽车所受阻力与车重之比 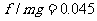 。 2分
。 2分
(3)当阳光垂直电磁板入射式,所需板面积最小,设其为S,
距太阳中心为r的球面面积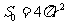 。
1分
。
1分
若没有能量的损耗,太阳能电池板接受到的太阳能功率为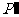 ,则
,则
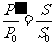 1分
1分
设太阳能电池板实际接收到的太阳能功率为P,
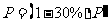 2分
2分
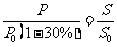 2分
2分
由于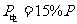 ,所以电池板的最小面积
,所以电池板的最小面积
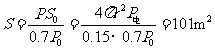 2分
2分
分析可行性并提出合理的改进建议。 2分
23.(18分)
(1)设土星的质量为M,岩石的质量为m,由圆周运动的规律得
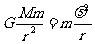 2分 所以
2分 所以 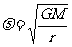 2分
2分
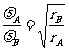 =
=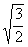 2分
2分
(2) 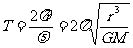 3分
3分
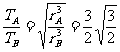 3分
3分
(3)设地球的质量为M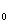 质量为m的物体在地球表面所受的重力为
质量为m的物体在地球表面所受的重力为
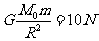 2分
2分
m距土星r处所受重力为 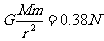 2分
2分
由以上两式得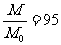 2分
2分
22.(1) CF AD (每空3分,共6分)
(2)电路图6分, 2 998.3 (每空2分)
31.(24分)
Ⅰ.(14分)番茄(2n=24)的正常植株(A)对矮生植物(a)为显形,红果(B)对黄果(b)为显形,两对基因独立遗传。请回答下列问题:
(1)现有基因型AaBB与aaBb的番茄杂交,其后代的基因型有 种,
基因型的植株自交产生的矮生黄果植株比例最高,自交后代的表现型及比例为 .
(2)在雌性AA与雄性aa杂交中,若A基因在的同源染色体在减数第一次分裂时不分离,产生的雌配子染色体数目为 ,这种情况下杂交后代的株高表现型可能是 。
(3)假设两种纯合突变体X和Y都是由控制株高的A基因突变产生的。检测突变基因转录的mRNA,发现X的第二个密码子中的第二个碱基由C变为U,Y在第二个密码子的第二个碱基前多了一个U。与正常植株相比, 突变体的株高变化可能更大,试从蛋白质水平分分析原因:
Ⅱ.(10分)“苏丹红一号”色素是一种人造偶氮苯类化学制剂,在人体内可形成二苯胺,二苯胺具有强烈的致癌性,全球多数国家都禁止将其用于食品生产。科学家通过实验发现,“苏丹红一号”会导致鼠类患癌,它在人类肝细胞研究中也显示出可能致癌的特性。科研人员欲采用一定的技术手段探究苏丹红是否对人体有危害。请回答:
(1)根据所学的动物细胞工程知识,你认为采取下列哪种技术手段最合适:( )
A.动物细胞融合 B.动物细胞培养 C.胚胎移植 D.核移植
(2)肝炎病毒感染久治不愈也会使病毒DNA整合到肝细胞中,引发肝癌。“苏丹红一号”致癌与之相比,从变异角度看,二者的主要区别在于 。
(3)根据上述选择,请你设计一个实验来探究“苏丹红一号”是否对人体有危害。
材料准备:从医院妇产科获取所需要的人的胚胎组织、浓度为0.09%“苏丹红一号”试剂、高倍显微镜、培养瓶若干、配制好的培养液、剪刀、培养箱、所需要的酶。
实验原理:许多致畸、致癌物质加入动物细胞培养液后,培养细胞会发生 。根据
可以判定某种物质的毒性。
实验步骤:①将上述组织用剪刀剪碎,再用 使其分散成单个细胞。
②用已配制好的培养液配制一定浓度的 。装入培养瓶置于培养箱中一段时间。
③ ④
⑤一段时间后,分别从上述培养瓶中取样制作多个临时装片镜检。
分析及结论:如果 则证明“苏丹红一号”对人体有危害。
月考四理科综合卷物理部分答案
选择题
A卷:14.D 15.D 16.D 17.AC 18.BD 19.AD 20.C 21.D
B卷:14.C 15.D 16.C 17.AC 18.BC 19.BD 20.C 21C
30.(18分)下面甲图表示小麦的部分细胞结构和相关代谢情况,a-f指02或CO2的去向。乙图表示在适宜的条件下,环境中的光照强度与光合作用强度之间的关系,请据图回答下列问题:
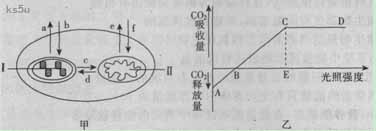
(1)甲图结构Ⅰ中,首先由 将光能转换成电能,再由电能转换成活跃的化学能,储存在 中。
(2)甲图中的c (填“可以”或“不可以”)表示葡萄糖的去向,原因是: 。
(3)当乙图中光强为B、E时,甲图a-f过程中可以发生的分别是:B ;E 。
(4)当其他条件适宜,植物少量缺镁时,乙图中B点会向 (填“左”或“右”)移动。
(5)乙图中C点以后,限制该植物光合作用效率的外界因素可能是 。
(6)若通过基因工程将某目的基因导入甲图中所示的细胞器工内,经组织培养的方法培育成转基因小麦。.此目的基因所控制的性状遗传的特点是 ;
29. (12分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学测其离子浓度大小顺序有如下4种关系:
① c(Cl-)>c(NH4+)>c(H+)>c(OH-) ② c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③ c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④ c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶液了一种溶质,则该溶质是___________,上述4种离子浓度的大小顺序为___________(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为__________________________。
若上述关系中④是正确的,则溶液中的溶质为___________________________________。
(3)若该溶液是体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)_______c(NH3•H2O)(填“大于”、“小于”或“等于”,下同),混合前酸中c(H+)和碱中c(OH-)的关系c(H+)__________c(OH-)。
28.(16分)已知以铜作催化剂,用空气氧化醇可制取醛,其反应原理是空气先与铜反应生成氧化铜,热的氧化铜再氧化醇生成醛。在实验室中用甲醇、水、空气和铜粉(或氧化铜)可制取甲醛溶液。常温下甲醇为液体,甲醛为气体;甲醇与甲醛均能与水混溶。
下图是两个同学设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,分别如甲和乙所示:
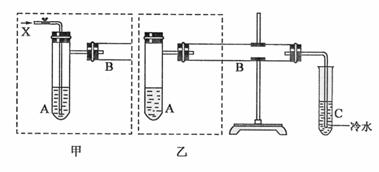
请回答下列问题:
(1)在仪器组装完成后,加装试剂前必须要进行的操作是 。
(2)若按甲装置进行实验,则通入A的X是 ,B中发生反应的化学方程式为 。
(3)若按乙装置进行实验,则B管中应装入的物质是 ,B中发生反应的化学方程式为 。
(4)两套装置中都需要加热的仪器有 (选填A、B、C)
(5)请设计简单的实验,检验实验后C中所得液体确为甲醛溶液。简述所用试剂、操作、现象及结论。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com