
题目列表(包括答案和解析)
4.用基因工程技术可使大肠杆菌合成人的蛋白质。下列叙述不正确的是( )
A.常用相同的限制性内切酶处理基因和质粒
B.DNA连接酶和 RNA聚合酶是构建重组质粒必需的工具酶
C.可用含抗生素的培养基检测大肠杆菌中是否导入了重组质粒
D.导入大肠杆菌的目的基因不一定能成功表达
3.还原糖、脂肪和蛋白质三种有机物的鉴定实验中,以下操作错误的是( )
A.可溶性还原糖的鉴定,可用酒精灯直接加热产生砖红色沉淀
B.只有脂肪的鉴定需要使用显微镜
C.用双缩脲试剂检测蛋白质不需要加热
D.使用斐林试剂和双缩脲试剂最好是现配现用
2.下列关于免疫的叙述,正确的是( )
A.吞噬细胞吞噬外来细菌,必须有抗体参与
B.B 细胞和 T细胞所含基因不同,功能也不同
C.“先天性胸腺发育不全”的患者,细胞免疫有缺陷
D.B 细胞与骨髓瘤细胞融合形成的杂交瘤细胞都能合成单克隆抗体
1.细胞分化是生物界普遍存在的一种生命现象,下列不正确的是 ( )
A.分化发生在生物体的整个生命进程中
B.分化是基因在特定的时间和空间条件下选择性表达的结果
C.未离体的体细胞不会表现出全能性
D.分化过程中遗传物质发生了改变
31.(22分)“假说-演绎法”是在观察和分析的基础上提出问题,通过推理和想像提出解释问题的假说,根据假说进行演绎推理,再通过实验检验演绎推理结论的科学方法。
(1)孟德尔以黄色圆粒纯种豌豆和绿色皱粒纯种豌豆做亲本,分别设计了纯合亲本杂交、F1自交、F1测交的实验,按照“假说-演绎”法(即分析现象-提出假说-检验假说-得出结论),最后得出了自由组合定律。孟德尔在两对相对性状的遗传实验中:
①用于解释实验现象的“假说”是 。受精时,雌雄配子的结合是随机的。雌雄配子的结合方式有16种;遗传因子组合类型有9种;F2代的性状表现为4种:黄色圆粒、黄色皱粒、绿色圆粒、绿色皱粒,数量比为9:3:3:l。
②根据假说的“演绎”过程是:若上述假说成立,则 。
③在检验假说阶段进行的实验是 。
(2)果蝇体表硬而长的毛称为刚毛,一个自然繁殖的直刚毛果蝇种群中,偶然出现了一只卷刚毛雄果蝇。已知直刚毛和卷刚毛是受等位基因A和a控制的。请回答下列问题:
①这只雄果蝇的卷刚毛性状是如何产生和遗传的呢?有一种假说认为这是亲代生殖细胞中X染色体上的基因发生了显性突变。请你尝试再写出两种假说: , 。
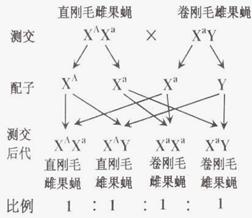 ②已知这只卷刚毛雄果蝇与直刚毛雌果蝇杂交,F1全部是直刚毛,F1雌雄果蝇随机交配,F2的表现型及比例是直刚毛雌果蝇:直刚毛雄果蝇:卷刚毛雄果蝇=2:1:1,此时最合理的假说是
。
②已知这只卷刚毛雄果蝇与直刚毛雌果蝇杂交,F1全部是直刚毛,F1雌雄果蝇随机交配,F2的表现型及比例是直刚毛雌果蝇:直刚毛雄果蝇:卷刚毛雄果蝇=2:1:1,此时最合理的假说是
。
③为验证②中的假说,某同学设计了如右图所示的杂交试验。该实验及现象是否能够验证第②小题中提出的假说?请说明理由: 。
④若为你提供以下一些纯合的果蝇作为材料:直刚毛雌果蝇、直刚毛雄果蝇、卷刚毛雌果蝇、卷刚毛雄果蝇,请你也来设计一个杂交试验,以验证第②小题中提出的假说,并预测实验结果:
实验方案: 。(只要求写出杂交亲本的表现型)。
预测结果: 。
台州中学2008/2009第一学期第二次统练
30.(24分)回答下面Ⅰ、Ⅱ两小题:
Ⅰ(10分)请回答下列有关动物生命活动的问题:
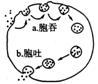 (1)右图表示动物细胞对大分子物质“胞吞”和“胞吐”的过程。a与b均要以
为基础才可能发生;a要有细胞识别和
才可能完成。甲状腺激素的分泌 (填:经过/不经过)b过程。
(1)右图表示动物细胞对大分子物质“胞吞”和“胞吐”的过程。a与b均要以
为基础才可能发生;a要有细胞识别和
才可能完成。甲状腺激素的分泌 (填:经过/不经过)b过程。
(2)甲状腺激素有多方面的功能。切除了甲状腺的动物,在低温环境中对寒冷刺激的耐受性__________,原因是__________________。
Ⅱ(14分)探究不同环境下植物生长的反应,实验如下图所示,装置A 花盆侧放在某一光照强度的地方;装置B 花盆侧放在一个不透光的木箱内;装置C 花盆摆放在一个有小孔的木箱中。请回答下列问题:
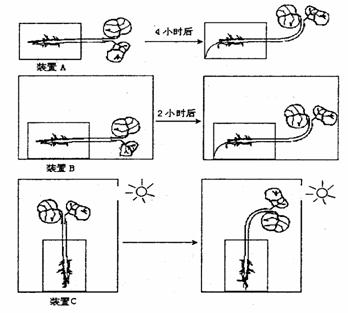
(1)以植物生长素调节机理解释,装置B 幼苗弯曲生长的原因是 。
(2)与装置A相比,装置B 的幼苗需要较长时间才能弯曲向上的原因可能是 。
(3)利用上述实验材料,进一步探究重力与某一光照强度单侧光照射对幼苗生长影响的相对强弱。请在方框中绘制装置图表示你的实验方案,并预测和分析实验结果。
 方案:
方案:
预测并分析实验结果:① 。
② 。
③ 。
29.(15分)有机物A由C、H、O、Cl四种元素组成,相对分子质量为198.5,Cl在侧链上。当A与Cl2分别在Fe作催化剂和光照条件下反应时,分别是苯环上一氯取代物有二种和侧链上一氯取代物有一种;A与NaHCO3反应时有气体放出。A经下列反应可逐步生成B-G。
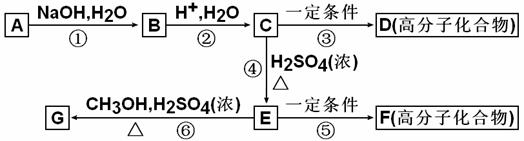
(1)A的化学式为__________________;D的结构简式为__________________;
(2)上述反应中属于取代反应的是__________________(填编号);
(3)C中含氧官能团的名称为__________________、__________________;
(4)E的同分异构体中,满足①苯环上只有一个侧链,且侧链上含有一个-CH3;②能发生银镜反应;③属于酯类。则其结构简式为(写3种):__________________、__________________、__________________;
(5)写出下列化学方程式:
A与NaOH醇溶液共热:______________________________________________________;
E在一定条件下生成F:______________________________________________________。
28.(14分)实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的物理性质如下表。请回答有关问题。
|
化合物 |
密度/g·cm-3 |
沸点/℃ |
溶解度/100g水 |
|
正丁醇 |
0.810 |
118.0 |
9 |
|
冰醋酸 |
1.049 |
118.1 |
∞ |
|
乙酸正丁酯 |
0.882 |
126.1 |
0.7 |
Ⅰ.乙酸正丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入11.5 mL正丁醇和9.4 mL冰醋酸,再加3-4滴浓硫酸。然后安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管,加热冷凝回流反应。
(1)本实验过程中可能产生多种有机副产物,写出其中两种的结构简式: 、
。
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是: 、
。
Ⅱ.乙酸正丁酯粗产品精制
(3)将乙酸正丁酯粗产品用如下操作进行精制:①水洗 ②蒸馏 ③用无水MgSO4干燥 ④用10%碳酸钠洗涤,正确的操作步骤是 (填字母)。
A.①②③④ B.③①④② C.①④①③② D.④①③②③
(4)将酯层采用如图所示装置蒸馏。
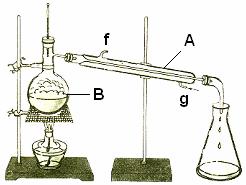
①写出图中仪器A的名称 ,冷却水从 口进入(填字母)。
②蒸馏收集乙酸正丁酯产品时,应将温度控制在 ℃左右。
Ⅲ.计算产率
(5)测量分水器内由乙酸与正丁醇反应生成的水体积为1.8 mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸正丁酯的产率是__________。
27.(15分)电解NaCl溶液(氯碱工业)所得产物均为化工生产中应用广泛的化工原料。请回答下列问题:
(1)写出电解NaCl溶液的离子反应式:
阳极________________________________,
总反应____________________________________________________________;
(2)常温下,将适量氯气通入NaOH溶液中可制得“漂白水”。若将等物质的量的氯气和NaOH反应,则所得溶液容易失效,写出该过程中发生反应的离子方程式____________________________________、____________________________________;
(3)已知氰酸的结构式为H-O-C≡N,在反应 KOCN+KOH+Cl2→CO2+N2+KCl+H2O (未配平)中,当有4molCO2生成时,被氧化的KOCN为__________mol;
(4)食醋总酸含量测定:①配制待测食醋溶液(稀释10倍);②待测食醋溶液装入酸式滴定管;③NaOH标准溶液装入碱式滴定管;④量取待测食醋溶液;⑤用NaOH标准溶液滴定待测食醋溶液;⑥数据处理(简略)
|
c(NaOH)=0.1010 mol·L-1 |
|||
|
实验次数 |
第一次 |
第二次 |
第三次 |
|
V(CH3COOH)/mL |
25.00 |
25.00 |
25.00 |
|
V(NaOH)/mL |
16.30 |
16.08 |
16.10 |
在食醋溶液中滴加2滴__________作为指示剂,食醋总酸含量的平均值为(保留两位有效数字)__________(g/100mL)。
26.(14分)Ⅰ.1914年,弗雷兹·哈伯(Fritz Haber)将N2和H2直接化合来合成氨。N2(g)+3H2(g)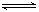 2NH3(g) △H=-92.4kJ·mol-1 氨气的用途有:生产铵盐、制纯碱、制硝酸、作制冷剂等。
2NH3(g) △H=-92.4kJ·mol-1 氨气的用途有:生产铵盐、制纯碱、制硝酸、作制冷剂等。
(1)写出该反应的平衡常数表达式K=__________________;在工业生产中,可以采取下列措施提高合成氨的产率。能用勒夏特列(Le Chatelier)原理解释的是__________________(填写编号);
A.向反应器中注入过量N2 B.采用适当的催化剂 C.在高压下进行反应
D.在较高温度下进行反应 E.冷却,不断移去液氨
(2) 氨氧化法制硝酸,反应分三步进行:①氨催化氧化;②一氧化氮与氧气反应;③用水吸收二氧化氮。写出反应方程式①____________________________________________;
Ⅱ. 2009年4月10日,上海金属期货交易所期铜全线涨停。黄铜矿(主要成分为CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(3)冶炼铜的反应为:8CuFeS2+21O2==8Cu+4FeO+2Fe2O3+16SO2。已知在CuFeS2中Fe的化合价为+2,则该冶炼铜的反应中被氧化的元素是__________(填写元素符号)。上述冶炼过程中会产生大量SO2。下列处理方案中不合理的是__________(填写编号)。
A.高空排放 B.用于制备硫酸 C.用纯碱溶液吸收制取Na2SO3 D.用浓硫酸吸收
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为:a.用稀盐酸浸取炉渣,过滤.b.滤液先经过氧化,再加入过量的NaOH溶液,反应后过滤;c.将沉淀洗涤、干燥、煅烧得Fe2O3。根据以上信息回答下列问题:
①除去Al3+总反应的离子方程式为________________________________________;
②Fe2+与H2O2(H+)反应的离子方程式为________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com