
题目列表(包括答案和解析)
2.下列关于遗传变异进化的说法,全部正确的有( )
①叶绿体中有等位基因,也可控制生物的某些性状,杂交后代也会出现性状分离
②两对基因独立遗传,若F2的分离比分别为9∶7和9∶6∶1,则F1进行测交,得到的性状分离比将分别为1∶3和1∶2∶1
③袁隆平培育的高产、抗逆性强的杂交水稻是基因突变的结果
④ 染色体中构成DNA的脱氧核甘酸的数量、种类和序列,三者中有一个发生改变,就会引起染色体变异
⑤基因突变、染色体变异、自然选择对种群的基因频率都有影响
⑥某大分子物质含有碱基U不含S元素,该物质的作用可能是携带氨基酸到核糖体
A.两项 B. 三项 C.四项 D.五项
1. 某种酶是由419个氨基酸形成的蛋白质。科学家利用生物技术做出5种不同长度的该酶的片段,并分别测定其活性如图所示,请分析该酶具有活性的部分最可能是下列( )一片段。

A.第196号氨基酸到第419号氨基酸 B.第1号氨基酸到第43号氨基酸
C.第44号氨基酸到第196号氨基酸 D.第197号氨基酸到第302号氨基酸
31、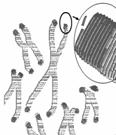 (22分)
(22分)
Ⅰ.2009年诺贝尔生理学或医学奖授予因发现端粒和端粒酶如何保护染色体的三位学者。
端粒(右图中染色体两端所示)通常是由富含鸟嘌呤核苷酸(G)的短的串联重复序列组成。它们能防止不同染色体末端发生错误融合。但是,细胞每分裂一次,端粒就会丢失一部分;在细胞衰老过程中端粒逐渐变小。端粒酶可利用某段RNA序列作为模板合成端粒DNA,对端粒有延伸作用。
⑴染色体末端发生错误融合属于染色体结构变异中的 ,结果使染色体上基因的 发生改变。
⑵从功能上看,端粒酶属于 酶。
⑶如果正常体细胞中不存在端粒酶的活性,你认为新复制出的DNA与亲代DNA完全相同吗? 。体外培养正常成纤维细胞,细胞中端粒长度与细胞增殖能力呈 (正相关、负相关)关系。
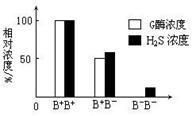
Ⅱ.正常小鼠体内常染色体上的B基因编码胱硫醚γ-裂解酶(G酶),体液中的H2S主要由G酶催化产生。为了研究G酶的功能,现需要选育基因型为B- B- 的小鼠。选育时可通过将小鼠一条常染色体上的B基因去除,培育出一只基因型为B+ B- 的雄性小鼠(B+ 表示具有B基因,B- 表示去除了B基因,B+ 和B- 不是显隐性关系)。请回答:
 (1)B基因控制G酶的合成,其中翻译过程在细胞质的核糖体上通过tRNA上的___________与mRNA上的碱基识别,将氨基酸转移到肽链上。
(1)B基因控制G酶的合成,其中翻译过程在细胞质的核糖体上通过tRNA上的___________与mRNA上的碱基识别,将氨基酸转移到肽链上。
(2)右图表示不同基因型小鼠血浆中G酶浓度和H2S浓度的关系。据图描述B+ B+ 和B+ B-个体的基因型、G酶浓度与H2S浓度之间的关系:__________________________________________。B- B-个体的血浆中没有G酶而仍有少量H2S产生,可能的原因是______________________ _。
(3)以该B+ B- 雄性小鼠与正常小鼠(B+ B+ )为亲本,进行杂交育种,选育B- B- 雌性小鼠。请将育种过程补充完整。
第一步:(用遗传图解表示在答题纸的方框中,其中表现型不作要求。)
第二步:(用遗传图解表示在答题纸的方框中,其中表现型不作要求。)
第三步:从子二代雌性小鼠中选出B- B-小鼠,选择的方法是__________________________。
30、(22分)肿瘤是危害人类健康的重要疾病。某医院病理室为确诊一患者的肿瘤是否恶性,切取了其一小块肿瘤组织进行培养。请回答下列有关问题:
(1)进行体外培养时,肿瘤组织必须先用____________________等处理成单个细胞。
(2)在培养中若要测量肿瘤细胞的数量,可以将待测样品与等量的已知含量的红细胞悬浮液混匀,涂布在载玻片上,经处理后观察。请设计一张用于记录观察数据的记录表,并推导出计算肿瘤细胞数目的公式。
①观察数据记录表:


②肿瘤细胞数的计算公式:____________________
(3)若在肿瘤细胞培养液中加入用3H标记的胸腺嘧啶脱氧核苷酸,短暂培养一段时间后,洗去3H标记的胸腺嘧啶脱氧核苷酸。使在该段时间内已处于DNA复制期不同阶段的全部细胞中DNA被3H标记,而当时处于其它时期的细胞则不带标记。不同时间取样做细胞放射性自显影,找出正处于有丝分裂的分裂期细胞,计算其中带3H标记的细胞占有丝分裂细胞的百分数。得到下图(图1-图4中横轴为时间,纵轴为带标记细胞占总细胞数的百分数):
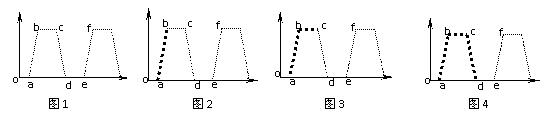

①图2中a点开始检测到带3H标记分裂期细胞,则o-a为 期,理由是: 。
②图2中b点带3H标记分裂期细胞数开始达到最大值,则a-b段表示 期,理由是: 。
③图3中c点时,带标记的细胞百分数开始下降,则a-c段表示哪些时期: 。
④此后,带标记的分裂期细胞数逐渐减少,直到消失,到第二次出现带有标记的细胞数时为图表中e点,则一个完整的细胞周期为: 。
(4)某科研单位研制出一种新型药物X,据说对此类肿瘤有较好的疗效,能起到抑制肿瘤细胞分裂的作用。研究者设计了以下方案加以验证,请将实验步骤补充完整:将肿瘤细胞悬浮液分成等细胞数的A、B两组。A组加入3H标记的胸腺嘧啶脱氧核苷酸,B组应加入 。相同条件下培养一段时间后,洗去培养液,把两组细胞做相应的处理,分别检测两组细胞的放射性强度。如果出现的实验现象为 ,则说明此药物的疗效好。
29、(14分)某种芳香族化合物A,其蒸气密度是相同条件下H2密度的82倍。A由碳、氢、氧三种元素组成,经测定碳、氢的质量分数分别为73.2%和7.32%。
(1)A的分子式是 。
(2)已知:
ⅰ. 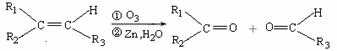 (R1、R2、R3代表烃基)
(R1、R2、R3代表烃基)
ⅱ. 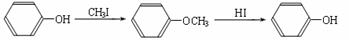
又知,A在一定条件下能发生如下转化,某些生成物(如H2O等)已略去。
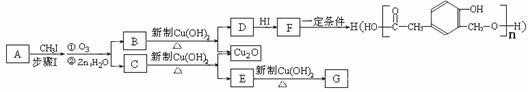
请回答:
① 步骤Ⅰ的目的是 ;
② 若G的相对分子质量是44,则E的结构简式是 ;E的核磁共振氢谱中有 个吸收峰(填数字);
③ F→H的反应类型是 ;
④ F在一定条件下可发生酯化反应,生成M(M与FeCl3反应,溶液呈紫色;且分子结构中含有苯环和一个七元环)请写出该反应的化学方程式 ;
⑤ A的结构简式是 ;上述转化中B→D的化学方程式是 。
(3)已知A的某种同分异构体K具有如下性质:
① K与FeCl3反应,溶液呈紫色;
② K在一定条件下可发生银镜反应;
③ K分子中苯环上的取代基上无甲基。
请写出K可能的结构简式 (写一种即可)。
28、(14分)某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应生成只有CuCO3一种沉淀;
乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀;
丙同学认为生成CuCO3和Cu(OH)2两种沉淀。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
(1)按照乙同学的理解Na2CO3溶液和CuSO4溶液反应的化学反应方程式为
;在探究沉淀物成分前,须将沉淀从溶液中分离并净化。具体操作为(填名称) 。
(2)请用下图所示装置,选择必要的试剂,定性探究生成物的成分。

① 各装置连接顺序为 → → 。
② 装置C中装有试剂的名称是 。
③ 能证明甲同学正确的实验现象是 。
(3)若CuCO3和Cu(OH)2两者都有,可通过下列所示装置的连接,进行定量分析来测定其组成。

① 装置C中碱石灰的作用是 ,
②实验开始时和实验结束时都要通入过量的空气其作用分别是 。
③ 若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为: 。
27、(14分)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
 C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,
①该反应能否自发进行与 有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)。
a.容器中的压强不变
b.1 mol H-H键断裂的同时断裂2 molH-O键
c. c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
 CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650 |
2 |
4 |
1.6 |
2.4 |
6 |
|
2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v(CO2) 表示的反应速率为 。(取小数二位,下同)
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K=_______.
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是 (用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
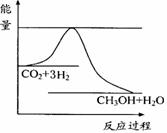 CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol
CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol
CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
(4)利用甲醇设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,采用铂或碳化钨作为电极催化剂。则通入氧气的电极应为 极(填写“正”或“负”), 放入甲醇的电极上发生的电极反应是
26、 (16分)
I. A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。
请回答下列问题:
(1)B、D在周期表中同处在_____族,B的原子结构示意图是_______,下列可以验证B与D两元素原子得电子能力强弱的实验事实是__________(填写编号);
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式______________________________________________:
(3)A、B、D间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有l0个电子,则甲与乙反应的离子方程式为________________;
(4)D元素的气态氢化物和其低价氧化物能反应生成D的单质.该反应中氧化产物与还原产物的物质的量之比为_________________。
II. 硝酸铜受热易分解:2Cu(NO3)2
 2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO
2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO  2Cu2O+
O2↑,至1000℃以上,CuO完全分解(加热过程中忽略
2Cu2O+
O2↑,至1000℃以上,CuO完全分解(加热过程中忽略
2NO2⇌N2O4,2NO2=2NO+O2等反应)。
现取5.64gCu(NO3)2无水晶体,在一定温度下使其分解,将生成的气体及时导出并用足量的NaOH溶液充分吸收。
(1)若该质量的无水硝酸铜经加热完全分解,其中的铜元素全部转化为氧化铜,则氧化铜的质量是_____________g。
(2)若该质量的无水硝酸铜完全分解,铜元素全部转化为氧化亚铜,反应过程中生成的气体被足量的NaOH溶液充分吸收后,还有多余的气体,则多余的气体是________(填分子式),其体积(标准状况)是_____________L,
(3)若该质量的无水硝酸铜分解后的残留固体中含有1.60g CuO,则残留固体的质量可能是______________________g。
25、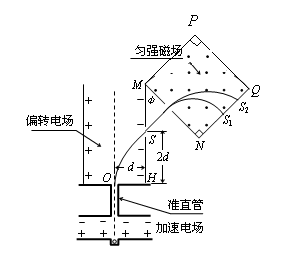 (22分)如图,离子源A产生的初速为零、带电量均为e、质量不同的正离子被电压为U0的加速电场加速后匀速通过准直管,垂直射入匀强偏转电场,偏转后通过极板HM上的小孔S离开电场,经过一段匀速直线运动,垂直于边界MN进入磁感应强度为B的正方形匀强磁场MNQP区域。已知HO=d,HS=2d。(忽略粒子所受重力)
(22分)如图,离子源A产生的初速为零、带电量均为e、质量不同的正离子被电压为U0的加速电场加速后匀速通过准直管,垂直射入匀强偏转电场,偏转后通过极板HM上的小孔S离开电场,经过一段匀速直线运动,垂直于边界MN进入磁感应强度为B的正方形匀强磁场MNQP区域。已知HO=d,HS=2d。(忽略粒子所受重力)
(1)求偏转电场场强E0的大小以及HM与MN的夹角 ;
;
(2)求质量为m的离子在磁场中做圆周运动的半径;
(3)若质量为4m的离子垂直打在NQ的中点S1处,质量为16m的离子打在S2处。求S1和S2之间的距离以及能打在NQ上的正离子的质量范围。
24、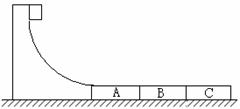 (18分)如图所示,某货场而将质量为m1=100 kg的货物(可视为质点)从高处运送至地面,为避免货物与地面发生撞击,现利用固定于地面的光滑四分之一圆轨道,使货物中轨道顶端无初速滑下,轨道半径R=1.8 m。地面上紧靠轨道次排放三个完全相同的木板A、B、C,长度均为l=2m,质量均为m2=100 kg,木板上表面与轨道末端相切。货物与木板间的动摩擦因数为
(18分)如图所示,某货场而将质量为m1=100 kg的货物(可视为质点)从高处运送至地面,为避免货物与地面发生撞击,现利用固定于地面的光滑四分之一圆轨道,使货物中轨道顶端无初速滑下,轨道半径R=1.8 m。地面上紧靠轨道次排放三个完全相同的木板A、B、C,长度均为l=2m,质量均为m2=100 kg,木板上表面与轨道末端相切。货物与木板间的动摩擦因数为 1,木板与地面间的动摩擦因数
1,木板与地面间的动摩擦因数 =0.2。(最大静摩擦力与滑动摩擦力大小相等,取g=10 m/s2)
=0.2。(最大静摩擦力与滑动摩擦力大小相等,取g=10 m/s2)
(1)求货物到达圆轨道末端时对轨道的压力大小。
(2)若货物滑上A木板时,木板不动,而滑上木板B时,木板B和C开始滑动,求 1应满足的条件。
1应满足的条件。
(3)若 1=0.7,求货物滑到木板A末端时的速度和在木板A上运动的时间。
1=0.7,求货物滑到木板A末端时的速度和在木板A上运动的时间。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com