
题目列表(包括答案和解析)
3.人类Rh血型有Rh+ 和Rh- 两种,分别由常染色体上显性基因R和隐性基因r控制。Rh+ 的人有Rh抗原,Rh- 的人无Rh抗原。若Rh+ 胎儿的Rh抗原进入Rh- 母亲体内且使母体产生Rh抗体,随后抗体进入胎儿体内则引起胎儿血液凝集和溶血;若这位Rh- 母亲又怀一Rh+ 胎儿,下列对这两胎儿的相关基因型及血液凝集和溶血程度的分析中,正确的是
①相关基因型与父亲的一定相同
②相关基因型与父亲的不一定相同
③两胎儿血液凝集和溶血程度相同
④第二胎儿血液凝集和溶血程度比第一胎儿严重
A.①③ B.①④ C.②③ D.②④
2.某条多肽的相对分子质量为2778,若氨基酸的平均相对分子质量为110,如考虑终止密码子,则编码该多肽的基因长度至少是
A.75对碱基 B.78对碱基 C.90对碱基 D.93对碱基
1. 在正常人体内环境稳态的调节中,前者随后者变化情况中与图中走势不符的是
在正常人体内环境稳态的调节中,前者随后者变化情况中与图中走势不符的是
A.抗利尿激素--饮水量
B.T细胞浓度--HIV浓度
C.促甲状腺激素浓度--甲状腺激素浓度
D.胰岛素浓度--血糖浓度
10.(21分)某化学兴趣小组探究饱和氯水与石灰石的反应.并制墩较浓的Hcl()溶液和对所得溶液中的部分阴离子进行检验。

(I)用平衡移动的观点解释石灰石溶解氯水的原因________________________--
_________________________________________________________________.
. (2)步骤2、步骤3的实验目的都是_____________,为达到该实
越目的,还可以采取的方法是
_______________________________________________________.
(3)请仿:设计一个简单的实验方案,证明步骤l所得滤液中的HCIO浓度比饱和氯
水中Hcl0浓度大_________________________________________.
Ⅱ.摩尔盐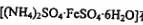 在空气中比一般亚铁盐稳定,是化学分析中常
在空气中比一般亚铁盐稳定,是化学分析中常
用的还原荆。某研究性学习小组按以下步骤制取摩尔盐: 。’
①用30%的NaOH溶液和废铁屑混合、煮沸、冷却、分离:
②用①处理过的铁屑和稀H2s仉反应制取FeS04:
③将③制得的FeS04:溶液与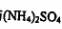 溶液混合,结晶得到摩尔盐.
溶液混合,结晶得到摩尔盐.
试回答下列问题:
如何从溶液中分解出摩尔盐______________.、
(2)如何设计-一个简单的实验证明得到的产品中有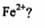 ______________________
______________________
(3)为确定产品中亚铁离子的含量,某研究小组用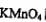 酸性溶液进行滴定,就写出该反应的离子方程式: _______________________.
酸性溶液进行滴定,就写出该反应的离子方程式: _______________________.
(4)现有等浓度的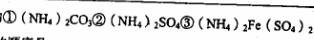 溶液.,其中
溶液.,其中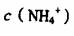 由大到小的顺序是____________ (填序号)。
由大到小的顺序是____________ (填序号)。


9.)(1 6分)加碘食盐中加人的碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解。在酸性条件下碘酸钾起一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。
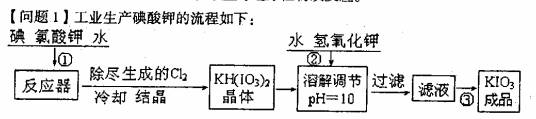
(1)已知步骤①反应器发生的反应中,两种还原产物所得电子数相同。请写出反
应器中发生反应的化学方程式:__________________________;
(2)参照下表碘酸钾的溶解度,操作③得到碘酸钾晶体,你建议的方法
是_____________________________
[问题2]已知:
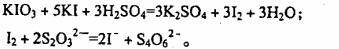
(1)测定加碘食盐中碘的含量,学生甲设计的实验步骤如下:
a.准确称取Wg食盐,加适量蒸馏水使其完全溶解:
b.用稀硫酸酸化所得溶液。加入过量K溶液,使K103与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10‘’mol/L的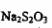 溶液
溶液
10 0mL,恰好反应完伞。则加碘食盐样品中的碘元素含量是 _______mg/g(以含
w的代数式袁示)。

①请推测实验中产生蓝色现象的可能原因,用离子方程式表示
___________________________________________________
②根据学生乙的实验结果,请对学生甲的实验结果作出简要评价:--(填
“偏大”、“偏小”或“正确”)。
其原因是________________________________________________.
4]写出H和r反应生成三酯的化学方程式:-------------。
8.(14分) (Ⅰ) 食品安全关系国计民生,影响食品安全的因素很多。
(1)聚偏二氯乙烯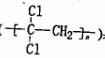 具有超强阻隔性能,可作为
具有超强阻隔性能,可作为
保鲜食品的包装材料。它是由_________(写结构简式)
发生加聚反应生成的
(2)劣质植物油中的亚油酸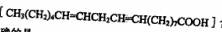 含量很低
含量很低
下列关于亚油酸说法正确的是_______(填序号)
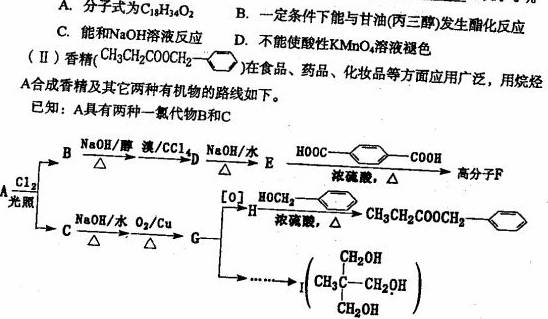
回答下列问题:
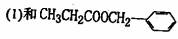 互为同分异构体的是 ______(填序号)。
互为同分异构体的是 ______(填序号)。
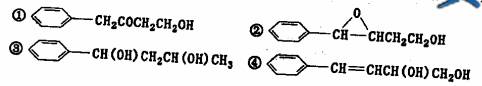
(2)D物质的名称为 ____________________-
(3)高分子F的结构简式____________________-;
(4)写出H和T生成三酯的化学方程式____________________
7.(13分)短周期元素a、b、c、d、e.f、g、h的原子序数依次增大.其中a和e、c和g、d和h同主族。b元素的最高正价和最低负价的绝对值之差为2;lmole单质能与冷水反应,在标准状况下生成11.2LH2;f原子最外层电子数等于其周期序数;h。的电子层结构与Ar原子相同。
(1)f原子结构示意图为_______;d和e形成的化合物电子式为______-;
(2)c和f简单离子的半径大小为_______;(用离子符号和‘,’、“=’’或“<.’
表示)
(3)元素非金属性强弱比较有很多方法,其中d和h的非金属性强弱的研究方案
中不可行的是 ___(填序号);
①比较两种单质的颜色 ②比较气态氢化物的稳定性
③比较与毗反应的剧烈程度 ④比较最高价氧化物对应水合物的酸性
(4)下图是上述部分元素形成的化合物的转化关系图,已知B和D都是具有刺激
性气味的气体,B是形成酸雨的污染物之一
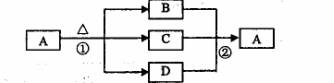 。
。
请按要求填空:
①化合物A的化学式____---。
②写出②反应的化学方程式 ____________ 。
3.阿斯巴甜具有清爽的甜味,甜味度约为蔗糖的200倍。有关说话不正确的是
A.阿斯巴甜的分子式为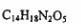
B.水解产物中有两种氨基酸
c.阿斯巴甜属于蛋白质 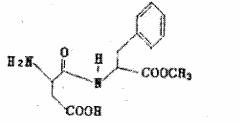
D.阿斯巴甜一定条件下既能与酸反应,又能与碱反应
4·金属加工后的废切削液中含2%一5%的NaN02,它是一种环境污染物。人们用
N'H4C1溶液来处理此废切削液,使NaN02转化为无毒物质。该反应分两步进行:
第一步:NaN02+NH4C1=NaCl+NH4N02
第二步:NH4N02=Nft+2H20
下列对第二步反应的叙述中正确的是( )。 、
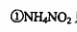 只是氧化剂
只是氧化剂 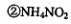 只是还原剂
只是还原剂
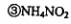 发生了分解反应 ④只有氮元素的化合价发生了变化
发生了分解反应 ④只有氮元素的化合价发生了变化
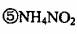 既是氧化剂又是还原剂
既是氧化剂又是还原剂
A·①③ B.①④ C.②③④D.⑤④⑤ .
5-在中学化学教材后所附的周期表中,若甲、乙、丙都是短周期元素,其中甲、
乙两元素原子的最外层电子数分别是次外层电子数的2倍和3倍,丙元素原子K层和M
层电子数之和与L层的电子数相同。下列有关判断中正确的是( )。
A·除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其它周期均为18种元素
C.乙元素的族序数比甲元素的族序数小
D.甲、丙元素最高价氧化物对应水化物的酸性强弱:甲<丙
6·一定温度下,将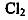 缓慢通人水中。当通人的
缓慢通人水中。当通人的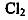 体积为
体积为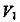 时达到饱和,溶液中
时达到饱和,溶液中
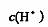 变化如下图中曲线a。已知
变化如下图中曲线a。已知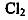 的溶解度随温度升高而迅速降低,下列叙述中正
的溶解度随温度升高而迅速降低,下列叙述中正
确的是( )。
A·将饱和氯水升温,继续通入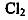 时,溶液中
时,溶液中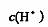 变化如曲线b
变化如曲线b
B.在饱和氯水中加入Na0H使pH>7,所得溶液中存在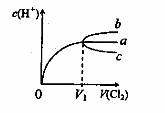
下列关系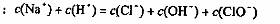
C.降温,不继续通人 时,溶液中
时,溶液中 增大 。
增大 。
D·在饱和氯水中加入NaOH使 pH=7,所得溶液中存在
下列关系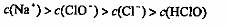
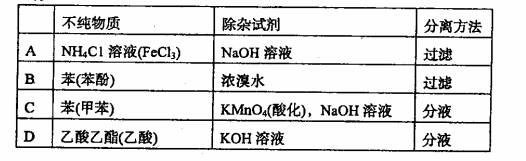
2.提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的
是( )。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com