
题目列表(包括答案和解析)
1.概念:正反应,向生成物方向进行的反应.
逆反应:向反应物方向进行的反应.
可逆反应:在同一要件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应.
5.卤化银和卤素离子的检验
|
|
AgF |
AgCl |
AgBr |
Agl |
|
色态 |
白色固体 |
白色固体 |
淡黄色固体 |
黄色固体 |
|
溶解性(水) |
易溶 |
难溶 |
难溶 |
难溶 |
|
稳定性 |
稳定 |
不稳定 |
不稳定 |
不稳定 |
|
主要用途 |
/ |
/ |
感光材料 |
人工降雨 |
4.卤素单质的置换反应
2KBr+Cl2=2KCl+Br2
2KI+Cl2=2KCl+I2
2KI+Br2=2KBr+I2
非金属活泼性(或氧化性):F2>Cl2>Br2>I2
还原性:F-<Cl-<Br-<I-
3.与金属反应:生成金属卤化物(设为RXn)
2R+nX2 = 2RXn
当R为Fe时,F2、Cl2、Br2均生成FeX3,而I2通常生成FeI2.
2.与H2O的反应:X2+H2O = HX+HXO
①单质与H2O反应的程度越来越小.
②特例:2F2+2H2O = 4HF+O2?
原因:氧化性F2>O2,卤素中只有F无正价,其它元素除有-1,0价外,还均有+1、+3、+5、+7价
单质呈现强氧化性,但随核电荷数的增加,原子核对外层电子的吸引能力逐渐减弱,它们得电子的能力也逐渐减弱,单质的氧化性F2>Cl2>Br2>I2.
1.与H2的反应:X2+H2 = 2HX
①.单质与氢的化合能力逐渐减弱,条件逐渐升高.
②.气态氢化物的稳定性:HF>HCl>HBr>HI
水溶液酸性:HF<HCl<HBr<HI
3.原子半径小于相应的离子半径
2.原子半径依次增大
卤素包括:F、Cl、Br、I、At(其中At为放射性元素,中学不作研究),它们的原子结构示意图分别为:
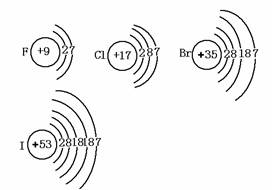
相同点:最外层都有7个电子,易得到一个电子形成8个电子的稳定结构,单质均为双原子分子.
递变性:
1.电子层数依次增多
13.学生甲称取一定量的KClO3,加入少量MnO2混合后在试管中加热,当他收得所需的O2后,停止加热并冷却.学生乙测知甲收集到O2的体积,他先称出甲实验后的固体质量为9.80g,继续加热至KClO3完全分解,得O21.613L(标况)最后他将加热后的固体投入足量水中,经过溶解,过滤、干燥后,称得不溶物的质量为1.54g.写出有关化学方程式,并计算学生甲在标况下收集到O2的体积.
[生活实际运用]
医院在抢救病危患者时常常要给病急患者输送氧气,为了携带方便,常常使用氧气包.若氧气包的氧气在常压下输出速率为10mL/S,现有一人在距医院有10分钟路程的地方发生车祸,问医护人员带上一个压强为3个大气压、容积为15L的氧气包是否够用?
解析:氧气包是否够用,实际上就是看其是否能维持10分钟的输出时间.先将3个大气压下的氧气转化为常压下的氧气,求出其体积.根据理想气体状态方程:P1V1=P2V2,V2=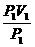 .
.
V2=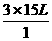 =45L=4.5×104mL
=45L=4.5×104mL
维持输出时间为:t=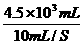 =4.5×103S=75分钟>10分钟
=4.5×103S=75分钟>10分钟
所以带一个氧气包够用.
[知识探究学习]
向某二价金属M的氢氧化物的澄清溶液100mL中加入过量的NaHCO3溶液生成MCO3沉淀,过滤,将沉淀置于足量盐酸中,在标准状况下收集到4.48L气体.将滤液加水稀释至250mL,取出25.0mL恰好与20.0mL盐酸完全反应并收集到1.12L(标准状况下)气体.
(1)若欲计算M的相对原子质量,你认为还必须提供下列哪组数据(填代号)( )
A.M的氢氧化物溶液的浓度(设为2.00mol·L-1)
B.MCO3沉淀的质量(设为39.4g)
C.与MCO3反应的盐酸的浓度(设为1.00mol·L-1)
D.题设条件充足,不需补充数据
(2)根据你的选择,求算M的相对原子质量和加入的NaHCO3溶液中含NaHCO3的质量.
解析:(1)本题涉及的反应有:
M(OH)2+2NaHCO3 = MCO3↓+Na2CO3+2H2O
MCO3+2HCl = MCl2+H2O+CO2↑
现已知n(CO2)=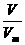 =
=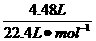 =0.2mol
=0.2mol
因n(MCO3)=n(CO2)=0.2mol,所以只要知道B,即可求得MCO3的摩尔质量,进而计算出M的相对原子质量.
(2)M(MCO3)=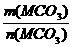 =
=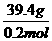 =197g/mol
=197g/mol
Mr(M)=197-(12+16×3)=137(Ba)
滤液中含有生成的Na2CO3和过量的NaHCO3,与盐酸反应后生成的气体仍为CO2: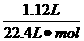 ×
×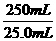 =0.5mol.
=0.5mol.
图示如下:
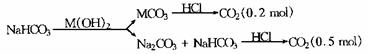
由碳元素守恒得:n(NaHCO3)=0.2mol+0.5mol=0.7mol.
所以m(NaHCO3)=0.7mol×84g/mol=58.8g.
答:略
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com