
题目列表(包括答案和解析)
13.6g-10.6g)+11.7g=14.7g
最后得到的溶液的质量为:
7.设碳酸钠的质量为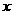 ,参加反应的氯化氢的质量为
,参加反应的氯化氢的质量为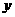 ,反应生成的氯化钠质量为
,反应生成的氯化钠质量为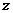
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73 117 44
x y z 4.4g
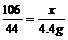
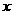 =l0.6g
=l0.6g
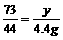
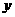 =7.3g
=7.3g
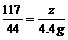
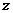 =11.7g
=11.7g
盐酸中溶质质量分数:7.3g×l00%=10%
最后得到的溶液中溶质质量为:
6.(1)1:1
(2)所设取样品中CaCl2的质量为x,反应生成NaCl的质量为y
CaCl2+Na2CO3=CaCO3↓+2NaCl
1l1 106 117
x 100g×10.6% y
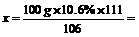 11.1g
11.1g
 11.7g
11.7g
则m(NaCl)=(22.8-11.1g)+11.7g=23.4g
ω(CaCl2)=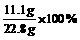 =48.7%
=48.7%
(3)溶液中水的质量:100g×(100%-10.6%)=89.4g
设t℃时89.4g水中NaCl的最大溶解量为m
则100g:36g=89.4g:m
m==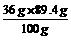 =32.2g>23.4g
=32.2g>23.4g
故样品检测后的溶液不是t℃时的NaCl饱和溶液
5.解;设样品中含Na2CO3的质量为x,生成NaCl的质量为y,依题意知产生CO2的质量为33.2g+130g-150g=13.2g。则:
Na2CO3+2HCl=2NaCl+CO2↑=H2O
106 117 44
x y 13.2g
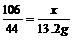 x=31.8g
x=31.8g
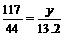 y=35.1g
y=35.1g
原样品中含NaCl 33.2g-31.8g=1.4g
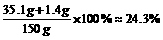
答:该纯碱样品中Na2CO3为31.8g,所得溶液中溶质的质量分数为24.3%。
4.(1)142;36:3:32(或72:6:64)
(2)解:设废料中铁的质量为x,稀硫酸中H2SO4的质量为y
Fe+H2SO4=FeSO4+H2↑
56 98 2
x y 0.1g
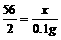 x=2.8g
x=2.8g
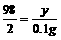 y=4.9g
y=4.9g
铜的质量分数为: 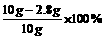 =72%
=72%
稀硫酸的质量分数为:
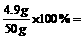 9.8%
9.8%
答;略
4.0g 10% x
= (1分)
x =49g (1分)
答:完全溶解这些固体产物至少需要溶质质量分数为10%的稀硫酸49g 。
(2)Cu2S (1分)
3.(5分)(1)解:设质量为x的这种稀硫酸可与4.0gCuO恰好完全反应
CuO + H2SO4 = CuSO4 + H2O (2分)
80 98
2.44
1.解:设原混合物中KClO3质量为x,依题意可知完全反应后生成氧气的质量为:
16g-11.2g=4.8g(1分)
MnO2
由 2KClO3=====2KCl+3O2↑ (1分)
△
25、(5分)纯铜呈紫红色,故又称紫铜。而铜的合金有黄铜、青铜和白铜等。其中Cu与Zn的合金称黄铜。黄铜有优良的导热性和耐腐蚀性,可用作各种仪器零件。为了测定某黄铜样品中铜的质量分数,取20克该黄铜样品加入到50克稀硫酸中,恰好完全反应,产生气体0.2克。反应的化学方程式为:Zn + H2S04 == ZnS04 + H2↑。试求:
(1)该黄铜样品中铜的质量分数。
(2)原稀硫酸溶液中溶质质量分数。
??
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com