
题目列表(包括答案和解析)
36、(4分)26.5%
解析:设NaHSO3为xmol,Na2SO3为ymol,
依题意有
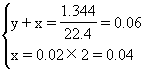
∴x=0.04(mol) y=0.02(mol)
本资料由《七彩教育网》 提供!
35.(6分)(1)(1分)113 ~ 450℃;(2)-2、+4、+6;(1分)(3)H2Te>H2Se>H2S;(1分)
(4)还原性 (1分) 2H2Se + O2 == 2H2O + 2Se;(1分)
(5)A12Te3 + ( 6H2O)一-2A1(OH)3↓ +3H2Te↑ (1分,连接符号不扣分)
34、(8分)解析:固态单质A能与空气中的氧气反应生成气体物质B,则A可能为C或S等,假定为S,则B为SO2,C为SO3,它们的相对分子质量为64∶80=4∶5,恰好与题意相符(同时也证明A不是C),则D为H2SO4,它是一种重要的工业原料,与题意也相符,进一步证明A为S。E为H2SO3。
答案:(1)H2+S H2S(写成可逆反应也正确)。
H2S(写成可逆反应也正确)。
(2)H2SO3 + 2H2S=3S + 3H2O。
(3)C+2H2SO4(浓) CO2
↑+2SO2 ↑+2H2O或Cu+ 2H2SO4(浓)
CO2
↑+2SO2 ↑+2H2O或Cu+ 2H2SO4(浓) CuSO4
+SO2 ↑+ 2H2O等。
CuSO4
+SO2 ↑+ 2H2O等。
(4)H2SO3 +2OH- = SO32- + 2H2O。
33、(10分)解析:因为这四种元素为同一短周期元素,W和X为金属元素,且各自的最高价氧化物对应的水化物可以反应生盐和水,所以W为Na,X为Al,Na与Y形成Na2Y,说明Y为-2价,即Y为S,则Z为Cl。
答案:(1)Al(OH)3+OH-=AlO2-+2H2O。
(2)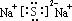
(3)SO2+Cl2+2H2O=H2SO4+ 2HCl。
(4)HCl>H2S。(5)S2- Cl- Na+ Ca2+
32、(5分)SiO2;CaSiO3;Na2SiO3;Si;H4SiO4(H2SiO3 )
31.(17分)
(2)仪器:试管、酒精灯、胶头滴管(各1分)
(3)(共12分,每空1分)
(4)实验结论:同周期元素金属性依次减弱;非金属性依次增强
(5)3Na2SiO3+2H3PO4=3H2SiO3↓+2Na3PO4
36.(4分)有Na2SO4、Na2SO3、NaHSO3的混合物共9.52g,与足量盐酸反应,放出1.344L(标准状况)气体;另取相同质量的该混合物与NaOH溶液反应,消耗20mL 2mol/L的NaOH溶液,求Na2SO4的质量分数。
衡水中学2008-2009学年度第二学期期中考试
高一化学试卷
1-30单项选择题,每小题2分
BABBD,BABAA,CDCAC,ADCBD,DCDAC,BDBAD
35、(6分)归纳整理是科学学习的重要方法之一。在学习了氧族元素的各种性质后,可归纳整理出如下表所示的表格(部分)。
|
性质\元素 |
8O |
16S |
34Se |
52Te |
|
单质熔点(℃) |
-218.4 |
113 |
|
450 |
|
单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
|
主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
|
原子半径 |
逐渐增大 |
|||
|
单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请根据表2回答下列问题:
(1)硒的熔点范围可能是 (2)碲的化合价可能有
(3)硫、硒,碲的氢化物水溶液的酸性由强至弱顺序是 (填化学式)。
(4)氢硒酸有较强的_________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为____________________________________
(5)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
____A12Te3 + ( ) →A1(OH)3↓ +H2Te↑
34、(8分)下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。
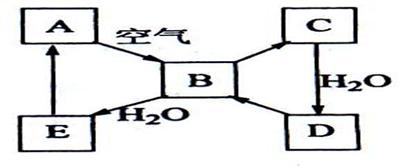
(1)写出A在加热条件下与H2反应的化学方程式
___________________________________________________
(2)写出E与A的氢化物反应生成A的化学方程式_________________
(3)写出一个由D生成B的化学方程式____________________;
(4)将5mL0.10mol·L-1的E溶液与10mL0.10 mol·L-1的NaOH溶液混合。
写出反应的离子方程式__________________________________________;
33.(10 分)W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为____________________。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为______________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_____________。
(4)比较Y、Z气态氢化物的稳定性_____>_______(用分子式表示)
(5)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是:_____>_____>______>______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com