
题目列表(包括答案和解析)
1.下列有关物理量相应的单位表达错误的是( )
A.物质的量浓度mol/ L B.溶解度g/100g C.气体摩尔体积L/mol D.密度g/cm3
32.(16分)根据元素周期表1-18号元素的性质和递变规律,回答下列问题。
(1)属于金属元素的有________种,金属性最强的元素与氧气反应生成的化合物有 __________(填两种化合物的化学式);
(2)属于稀有气体的是___________(填元素符号,下同);
(3原子半径最大的是(稀有气体除外)______________;
(4)气态氢化物最稳定的是 ,推测Si、N气态氢化物的稳定性_________大于_________(填化学式)。
(5)最高价氧化物对应水化物碱性最强的是 ,酸性最强的是 (填化学式),二者分别与Al(OH)3反应的离子方程式为 , 。
33(5分)有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:
 从实验可以判断:
从实验可以判断:
⑴该固体粉末中一定不含有 ;
⑵该固体粉末中一定含有 和 ;
⑶它的第三种成分只能是______________或 _ ____ ____中的一种。
34(13分)图中每方框内字母表示有关的一种反应物或生成物(生成C时的其他产物或其他反应中生成的水已略去),其中A、F为酸,D、E为盐,C、G为气体。
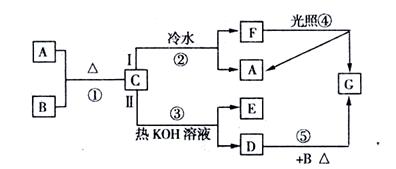
据此,试回答下列有关问题:
(1)写出相应物质的化学式:D ;F ;G 。
(2)写出反应②、③的离子方程式:反应②: ;
反应③: 。
(3)写出反应④、⑤的化学方程式:反应④
反应⑤
(4)a mol C无论按途径Ⅰ,还是按途径Ⅱ,只要完全反应,最终产生G的物质的量均为 mol.
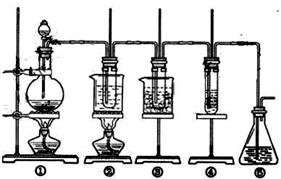
35(14分)在实验室中可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中: ① 为氯气发生装置;②的试管里盛有15mL30%KOH 溶液.并置于水浴中; ③ 的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④ 的试管里加有紫色石蕊试液; ⑤ 为尾气吸收装置。
 请填写下列空白:
( l )制取氯气时,在烧瓶里加入一定量的二氧化锰,通过__________________(填写仪器名称)向烧瓶中加入适量的浓盐酸,反应的化学方程式为:
请填写下列空白:
( l )制取氯气时,在烧瓶里加入一定量的二氧化锰,通过__________________(填写仪器名称)向烧瓶中加入适量的浓盐酸,反应的化学方程式为:
实验时为了除去氯气中的氯化氢气体,可在① 与② 之间安装盛有_________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
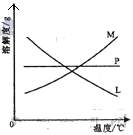 ( 2 )比较制取氯酸钾和次氯酸钠的条件.二者的差异是:
( 2 )比较制取氯酸钾和次氯酸钠的条件.二者的差异是:
______________________________________________________
反应完毕经冷却后,② 的试管中有大量晶体析出。右图中符合该
晶体溶解度曲线的是_____________________(填写编号字母);从②的试管中分离出该晶体的方法是____________________(填写实验操作名称)
(3)本实验中制取次氯酸钠的离子方程式是:
__________________________________________ _
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为____色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
_______________________________________________ |
|
然后溶液从无色逐渐变为____色 |
_______________________________________________ |
36(7分)把铝、铁混合物1.1 g溶于200 mL 5mol/L盐酸中,反应后盐酸的浓度变为4.6mol/L(溶液体积变化忽略不计).
求:(1)反应中消耗HCl的物质的量.
(2)该混合物中铝、铁的物质的量.
2008-2009学年度下学期第一次调研考试
30、甲、乙两种非金属:①甲比乙容易与氢气化合 ②甲元素的单质能与乙的阴离子发生氧化还原反应③甲的最高价氧化物对应水化物的酸性比乙的最高价氧化物对应水化物酸性强④与某金属反应时,甲比乙得电子数多⑤甲的单质熔沸点比乙的低。能说明甲比乙的非金属性强的是:
A、只有④ B、只有⑤ C、①②③ D、①②③④⑤
 第Ⅱ卷(非选择题,共60分)
第Ⅱ卷(非选择题,共60分)
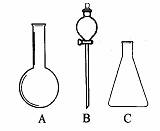
31(5分)(1)有右下图所示A、B、C三种仪器:请选择下列仪器名称的序号,填入相应的空格内:
①烧杯 ②普通漏斗 ③圆底烧瓶 ④锥形瓶 ⑤分液漏斗
A______________B______________C______________
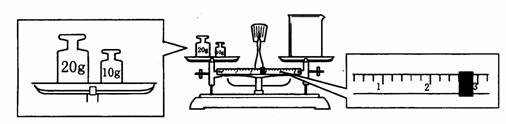
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是______________,烧杯的实际质量为____________g.
29、在含有37g Ca(OH)2的澄清石灰水中,通入a LCO2气体(标准状况下),可得25克白色沉淀,则a值为:
A、5.6 B、11.2 C、16.8 D、22.4
28、进行下列实验时没有燃烧现象的是:
A、棉花包住过氧化钠置于石棉网上滴加几滴水 B、将一小块铷放入水中
C、将一小块钠置于空气中 D、将一小块铯置于空气中
27、把4.48LCO2通过一定质量的过氧化钠后,收集到3.36L气体(气体均为标准状况下),则这3.36L气体的质量是: ( )
A、3.8g B、5.6g C、4.8g D、6.0g
26、下列关于碱金属元素叙述中,正确的是( )
A、单质的密度都小于水 B、原子的最外层电子数都是1,次外层电子数都是8
C、除锂外均以化合态存在于自然界中 D、单质的化学性质活泼,易失电子发生氧化反应
25.某金属的硝酸盐受热分解生成NO2、O2和该金属的氧化物。已知NO2和O2的分子个数比为4∶1,则在分解过程中该金属的化合价将 ( )
A.无法确定 B.升高 C.不变 D.降低
24、某溶液中Cl-、Br-、I-三者物质的量之比是1:2:3,通入一定量的Cl2,当反应完成后,该比值变为3:2:1,则反应的Cl2与原溶液中I-的物质的量之比是( )
A.1:2 B.1:3 C.1:4 D.1:6
23、右图是硫酸试剂标签上的部分内容。下列说法正确的是
A.该硫酸的物质的量浓度为9.2 mol/L
B.该硫酸与等体积的水混合后,所得溶液的质量分数为49%
C.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D.该硫酸与等质量的水混合所得溶液的物质的量浓度等于9.2 mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com