
题目列表(包括答案和解析)
2.下列物质的分类组合正确的是 ( )
|
编组 |
强电解质 |
弱电解质 |
非电解质 |
|
A |
NCl |
HF |
Cl2 |
|
B |
H2SO4 |
BaCO3 |
CS2 |
|
C |
AgCl |
HClO |
Cu |
|
D |
Ba(OH)2 |
H2S |
C2H5OH |
1.以NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1.8gNH4+离子含有的电子数是NA
B.常温常压下,1molNH3所含的电子数为NA
C.28gCO和N2的混合气体含NA个不同原子
D.1molFeCl3跟沸水反应转化成氢氧化铁胶体溶液,生成胶体的微粒数目为NA
23、(4分)在标准状况下 ①6.72L CH4气体 ②3.01×1023个HCl气体分子
③13.6g H2S气体 ④0.2mol NH3, 下列对这四种气体的关系从大到小的排列是(用上述数字序号表示)
(1)标准状况下四种气体的体积_________________________
(2)四种气体的质量______________________________________
22.(1)(4分)100mL 98%的浓H2SO4,其密度为1.84g/cm3。该浓H2SO4的物质的量浓度为
______________________,稀释至500mL后,其物质的量浓度为__________________。
(2)(7分)同温同压下,同体积的H2和CO2物质的量之比为___________,原子个数之
比__________,质量比___________;同温同压下,同质量的H2和CO2分子个数之比
________,原子个数之比__________,体积比为_______________;若两者所含原子
个数相等,它们的物质的量比是 ________ __。
21、(8分)实验室欲配制0.5mol/L的NaOH溶液500mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为____________________________。
(2)某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是_____________________________________ ,烧杯的实际质量为______________g
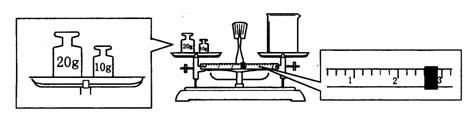
(3)使用容量瓶前必须进行的一步操作是_____________________。
(4)在配制过程中,其他操作都正确的,下列操作会引起误差偏高的是__________。
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视标线
⑤定容时仰视标线
⑥ 定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
20.(6分)现在NaOH 、Na2CO3、Ba(OH)2三种无色溶液,请选用一种试剂把它们鉴别出来,你选择的试剂是____________________,简述实验操作及现象和结论:
________________________________________________________________
_________________________________________________________________
_________________________________________________________________
与你选择的试剂进行实验有关的离子方程式为
_________________________________________________________
_______________________________________________________
__________________________________________________________
19.(8分)写出与下列离子方程式相对应的化学方程式,是氧化还原反应的要用双线桥标出电子转移的方向和数目,并指出氧化剂和还原剂。
① 2H+ +CaCO3 =Ca2++ CO2↑+ H2O___________________________________
② Cu + 2Ag+ == Cu2+ + 2Ag________________________________________
③ MgO + 2H+ ==Mg2+ + H2O _________________________________________
④ Cu2+ + Fe == Cu + Fe2+________________________________________
18.(1)(4分)根据交叉分类法,请用斜线将下面框图的盐与盐的分类连接起来:

(2)(8分)现有下列物质:A.豆浆 B.食盐水 C.铁 D.硫酸 E.氢氧化钠固体 F.纯碱 G.泥水 H.二氧化碳 I.水。请将它们的序号或所属类别填充到下列横线上。

17、下列离子方程式的书写正确的是 ( )
A、实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O
B、硫酸铜与Ba(OH)2溶液反应 Cu2++ 2OH-== Cu(OH)2↓
C、Cu(OH)2与盐酸反应:H+ + OH-==H2O
D、NaHCO3溶液与稀盐酸反应: H+ + HCO3- =CO2↑+ H2O
第Ⅱ卷(非选择题 共49分)
16、用10 mL 0.1 mol/L BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是 ( )
A、3∶2∶2 B、1∶2∶3 C、1∶3∶3 D、3∶1∶1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com