
题目列表(包括答案和解析)
7.100 ml浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的6 mol·L-1的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
6、在一定温度下,可逆反应A(g)+3B(g) 2C(g)达到平衡状态的标志是
2C(g)达到平衡状态的标志是
A. C生成的速率与A分解的速率2倍相等
B. 单位时间生成n mol A,同时生成3n mol B
C. A、B、C的浓度不再变化
D. A、B、C的分子数比为1∶3∶2
4、已知反应X+Y= M+N为吸热反应,对这个反应的下列说法中正确的是
A、X的能量一定低于M的,Y的能量一定低于N的
B、因为该反应为吸热反应,故一定要加热反应才能进行
C、破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D、X和Y的总能量一定低于M和N的总能量
|
 5、镍氢电池的总反应式是 H2+2NiO(OH) 2Ni(OH) 2,根据此反应式判断,此电池放电时,负极上发生反应的物质是( )
5、镍氢电池的总反应式是 H2+2NiO(OH) 2Ni(OH) 2,根据此反应式判断,此电池放电时,负极上发生反应的物质是( )
A、NiO(OH) B、Ni(OH) 2 C、H2 D、H2和NiO(OH)
3、.某原电池的离子方程式是Zn + Cu2+ = Zn2+ + Cu,该原电池正确的组成是
|
|
正极 |
负极 |
电解质溶液 |
|
A. |
Cu |
Zn |
HCl |
|
B. |
Zn |
Cu |
CuSO4 |
|
C. |
Cu |
Zn |
CuSO4 |
|
D. |
Cu |
Zn |
ZnCl2 |
2.下列说法不正确的是( )
A.通过煤的干馏可以获得焦炭
B.煤中含有苯和甲苯,可以用蒸馏的方法把它们分离出来
C.通过煤的干馏可以获得粗氨水
D.煤液化后可以得到甲醇
1.苯加溴水后,溴水层颜色变浅,这是由于( )
A.溴挥发了 B.发生了取代反应 C.发生了萃取 D.发生了加成反应
25.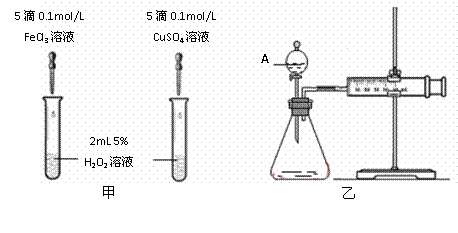 为比较Fe2+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:
为比较Fe2+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:
(1)定性分析:如图甲可通过观察 定性比较得出结论,有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,实验中需要测量的是 。
(3)某同学要利用乙装置测定某H2O2溶液的物质的量浓度。在锥形瓶中加入0.10 mol MnO2粉末后加入50 mL 该H2O2溶液,在标准状况下放出气体的体积和时间的关系如图所示。
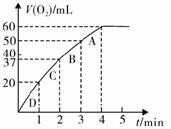
①写出H2O2在MnO2作用下发生反应的化学方程式 ;
②实验中放出气体的总体积是 mL;
③A、B、C、D各点反应速率快慢的顺序为 > > > ;
④计算H2O2的初始的物质的量浓度 。(结果保留2位小数)
24.海洋约占地球表面积的71%,海水化学资源的利用具有非常广阔的前景。
(1)海水晒盐可获得粗盐,在实验室中粗盐经过溶解、 、 可制得精盐。
(2)镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的,其主要步骤如下:
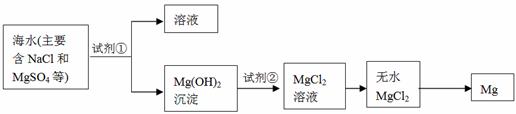
①为了使MgSO4转化为Mg(OH) 2,试剂①可以选用 ,要使MgSO4完全转化为沉淀,加入试剂①的量应 ;
②试剂②可以选用 ;
③试从节约能源、提高金属镁的纯度分析,以下适宜的冶镁方法是 。
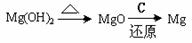
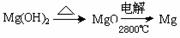 A.
B.
A.
B.
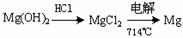
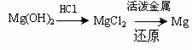
C. D.
(3)溴及其化合物用途十分广泛,我国正在大力开展海水提溴的研究和开发工作。工业以浓缩海水为原料提取溴的部分过程如下:
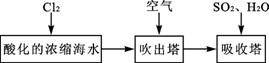
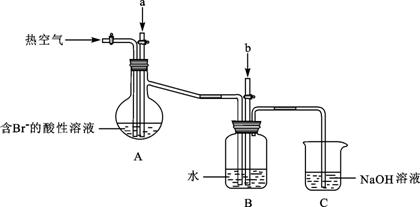 某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):
①A装置中通入a气体的目的是(用离子方程式表示) ;
②A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是
;
③反应过程中,B装置中有SO42-生成。检验SO42-的方法是 ;
④C装置的作用是 。
23.有机化学知识在生活中应用广泛。
(1)糖类、油脂和蛋白质是动物性和植物性食物中的基本营养物质。
①下列有关说法中,正确的是 ;
A.棉、麻、木材、蚕丝的主要成分都是纤维素
B.油脂是产生能量最高的营养物质
C.蛋白质在人体内发生水解最终生成氨基酸
D.糖类都是有甜味的物质
E.淀粉、纤维素、蛋白质都是天然高分子化合物
F.硫酸铵或乙酸铅溶液加入到蛋白质溶液中,蛋白质都能从溶液中析出
②葡萄糖是最重要、最简单的单糖,除了是一种营养物质,还能用在制镜等工业上。写出
葡萄糖发生银镜反应的化学方程式: 。
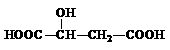
(2)苹果酸常用作汽水、糖果的添加剂,其结构简式为 ,该分子中官能团的名称为 ,可以和醇类物质发生 反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为 。
(3)实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
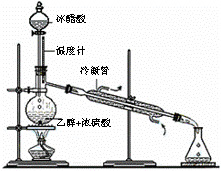
①在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是 ;
②生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述能说明该反应已达到化学平衡状态的有(填序号) ;
A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的浓度不再变化
③现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。
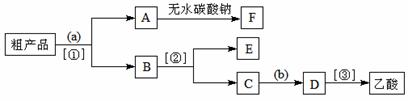
试剂a是 ,分离方法①是 ;分离方法②是 ,试剂b是 ;
④写出C → D 反应的化学方程式 。
22.原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH + HCl = NaCl + H2O,
B.2FeCl3 + Cu = 2FeCl2 + CuCl2
判断能否设计成原电池A. B. 。(填“能”或“不能”)
(2)由铜片、锌片和足量稀H2SO4组成的原电池中,若锌片只发生原电池腐蚀,一段时间后某电极产生3.36L标准状况下的气体。
①负极是 (填“锌”或“铜”),发生 反应(填“氧化”或“还原”);
②正极的电极反应式为 ;
③产生这些气体共需转移电子 mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com