
题目列表(包括答案和解析)
3.元素的性质呈周期性变化的根本原因是( )
A.元素的相对原子质量的递增,量变引起质变
B.元素的原子半径呈周期性变化
C.元素原子的核外电子排布呈周期性变化
 D.元素的金属性和非金属性呈周期性变化
D.元素的金属性和非金属性呈周期性变化
2.在密闭容器中进行的如下反应: ,下列叙述错误的是( )
,下列叙述错误的是( )
A.达到平衡时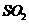 与
与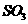 的浓度相等
的浓度相等
B.使用催化剂是为了加快反应速率,提高生产效率
C.在上述条件下,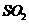 不可能100%地转化为
不可能100%地转化为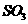
D.为了提高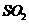 的转化率,应适当提高
的转化率,应适当提高 的浓度
的浓度
1.下列关于物质性质变化的比较,不正确的是( )
A.原子半径: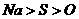 B.酸性强弱:
B.酸性强弱: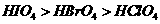
C.碱性强弱: D.金属性强弱:
D.金属性强弱: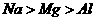
21.(10分)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
|
实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
|
① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响;高&考%资(源#网 (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响;) |
|
② |
|
粗颗粒 |
|
|
|
③ |
|
|
|
|
|
④ |
298 |
|
|
(2)实验①中CO2质量随时间变化的关系见右图:
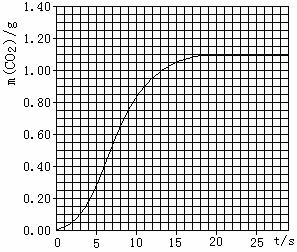 依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在6s-11s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程,结果保留两位小数)。
依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在6s-11s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程,结果保留两位小数)。
亳州市2009-2010学年度第二学期教学检测模块测试卷
20.(12分)A是在人们日常生活中最常见的有机物,75℅(体积分数)的水溶液可用于医疗消毒,并能进行如图所示的多种反应,通常情况下C是一种具有果香味的无色液体。
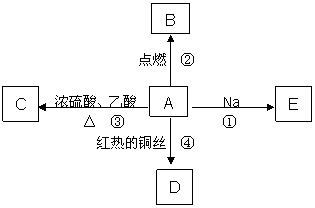
(1)A的名称 ;C的分子式为 。
(2)写出下列反应的化学方程式:
 反应② ;
反应② ;
 反应④
。
反应④
。
 (3)比较反应①与钠和水反应的现象有什么相同和不同:
(3)比较反应①与钠和水反应的现象有什么相同和不同:
 相同点: ;
相同点: ;
 不同点: 。
不同点: 。
19.(10分)取标况下11.2LC2H4在氧气中完全燃烧,120℃时将气体产物作如下处理,回答有关问题:
(1)若将气体先通过浓硫酸再通过碱石灰,碱石灰将增重______g。
(2)若将气体直接通过碱石灰,则碱石灰将增重______g。
(3)若将气体通过足量过氧化钠,则过氧化钠将增重_______g。
(4)C2H4可以和氢气反应生成C2H6,此反应属于 反应,若将以上C2H4与氢气反应后的产物与足量的氯气进行光照,最多可以生成氯化氢气体 mol。
18.(10分)下图是某温度下,在2L容器中某可逆反应X、Y、Z三种物质的浓度与时间的关系图,根据图中信息回答下列问题:
(1)由图中的数据分析,该反应的化学方程式为 ;
(2)用X表示的化学反应速率为 mol/(L·min),如果升高温度,达到平衡时的时间会变 (填长、短、不能确定或不变)
(3)5min后Z的生成速率 5min时Z的生成速率(填大于、小于或等于)。
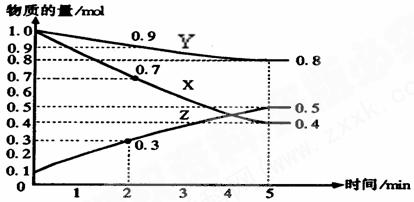 (4)达到平衡时X的转化率为 ;
(4)达到平衡时X的转化率为 ;
17.(10分)下表是元素周期表的一部分,请从表中所标明的十种元素中回答下列有关问题:
|
(1)表中化学性质最活泼的金属元素是______;在自然界中 形成的化合物种类最多(均填元素符号) ;
(2)表中有一种能形成两性氢氧化物的元素,写出该元素的单质与⑨元素最高价氧化物的水化物反应的离子方程式是__________________;
(3)④元素与⑦元素形成化合物的电子式__________________该化合物中所含化学键类型为__________________(填共价键或离子键)
(4)③、⑦、⑩元素中,阴离子还原性最强的是__________________(填离子符号)。
16.在一定条件下,NO跟NH3可以发生反应:6NO+4NH3=5N2+6H2O,该反应中被氧化和被还原的氮元素的质量比是 ( )
A.3∶2 B.2∶1 C.1∶1 D.2∶3
第Ⅱ卷(共52分)
15.下列反应的离子方程式正确的是 ( )
A.钠与水的反应:Na+H2O=Na++OH-+H2↑
B.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
C.氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com