
题目列表(包括答案和解析)
2. 若短周期中的两种元素可以形成X2Y3型分子, 则这两种元素的原子序数之差不可能是( )
A. 1 B. 3 C. 5 D. 6
[解析]选D。由化合物X2Y3可推知X、Y的价态分别为+3, -2价, X可能为B或Al; Y可能为O或S, 对应的化合物为B2O3、Al2O3、B2S3、Al2S3, 原子序数的差值分别为3、5、11、3; 还有N2O3, 其原子序数之差为1, 不可能是6。
1. (2010·徐州高一检测)月球的土壤中含有丰富的可控核聚变燃料3He, 月海玄武岩中蕴藏着丰富的钛、铁、铬、镍、钠、镁、硅、铜等金属矿产资源和大量的二氧化硅、硫化物等, 将为人类社会的可持续发展作出贡献。下列有关叙述 正确的是(
)
正确的是(
)
A. 月球上的二氧化硅所含元素都是第三周期元素
B. 3He可发生核聚变反应, 这是一种化学变化
C. 月球上的3He是一种新元素
D. 月球和地球上的钛、铁、铬、镍等原子应该具有相同的核外电子排布
[解析]选D。SiO2中氧元素在第二周期, A错; 核聚变反应会改变元素种类, 不是化学变化, B错; 3He是He元素的一种核素, 而不是新元素, C错; 月球上的元素原子核外电子排布和地球上的完全一样, D正确。
21.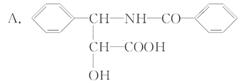 (10分)癌症严重威胁着人类的生命,为了战胜癌症,科学家正致力于研究癌症发生的机理和抗癌药物。紫杉醇(俗
(10分)癌症严重威胁着人类的生命,为了战胜癌症,科学家正致力于研究癌症发生的机理和抗癌药物。紫杉醇(俗 名)是一种新型抗癌药,其分子式为C47H51NO14,它是由如下的酸A和醇B形成的一种酯。
名)是一种新型抗癌药,其分子式为C47H51NO14,它是由如下的酸A和醇B形成的一种酯。
(分子式为:C16H15NO4)
B.R-OH(R中含C、H、O元素)
(1)写出R-OH的分子式:___________。
(2)根据A的结构,A可能发生的化学反应类型有______________________(填序号)。
①取代反应 ②消去反应 ③氧化反应 ④加成反应
(3)1 mol A与Na反应,最多可产生 _______mol H2。
(4)A中与N原子直接相连的C、H原子______(填“能”或“不能”)与N处于同一平面。
(5)已知反应:R-NH2+HCl R-NH3Cl(盐酸盐),则A在足量稀盐酸作用下可发生水解反应,其反应的化学方程式为______________________。
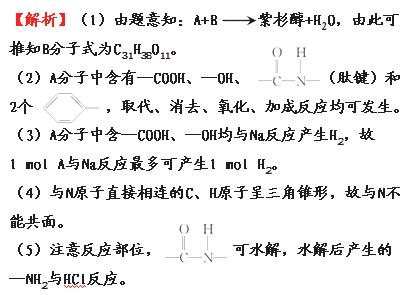
答案:(1)C31H38O11 (2)①②③④
(3)1 (4)不能
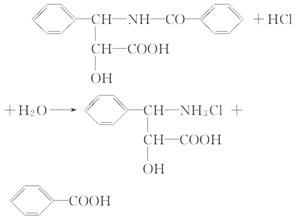 (5
(5
20.(11分)已知:A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志。根据下图所示的转化关系回答问题。
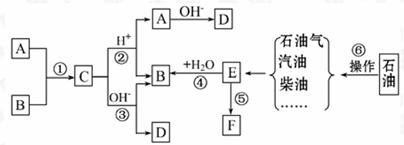
(1)操作⑥的名称为________。
(2)取代反应的范畴很广,①-⑤中属于取代反应的是_____________________(填序号)。
(3)请写出下列反应的化学方程式:
①__________________________________________;
③__________________________________________;
⑤__________________________________________。
(4)F是一种常见的高分子材料,它给我们带来了巨大的方便。然而,这种材料造成的当今的某一环境问题是______
___________________________________________。
[解析]根据“E是石油化工发展水平的标志”可知E为乙烯。一方面,乙烯可以转化成F,另一方面,乙烯与水反应生成B。结合B、F都是家庭中常见的有机物的信息,推断B是乙醇,F是聚乙烯。观察框图,C在酸性或碱性条件下都可以得到乙醇,说明C是某种酸与乙醇反应生成的酯。因为这种酸是家庭中常见的有机物,则A是乙酸。其他答案可依次推出。
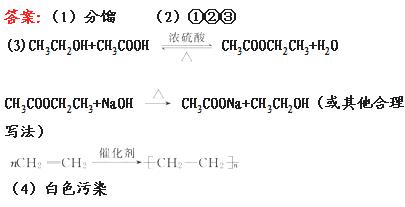
19.(9分)工业上从海水中提取单质溴可采用如下方法:
(1)向海水中通入Cl2,将海水中的溴化物氧化,其离子方程式为____________________________________。
(2)向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,其化学方程式为____________________
___________________________________________。
(3)将(2)所得溶液用H2SO4酸化,使NaBr、NaB rO3中的溴转化为单质溴,再用有机溶剂萃取溴后
rO3中的溴转化为单质溴,再用有机溶剂萃取溴后 ,还可得到副产品Na2SO4,这一过程可用化学方程式表示为_________
,还可得到副产品Na2SO4,这一过程可用化学方程式表示为_________
___________________________________________。
这样得到的溴中还混有少量Cl2,进一步净化后可得纯溴。
[解析](1)Cl2将海水中的Br- 氧化生成Br2。
(2)Br2在较高温度且碱性条件下发生自身氧化还原反应。
(3)NaBr、NaBrO3在酸性条件下发生氧化还原反应。
答案:(1)Cl2+2Br- =====2Cl- +Br2
(2)3Br2+3Na2CO3  5NaBr+NaBrO3+3CO2↑
5NaBr+NaBrO3+3CO2↑
(3)5NaBr+NaBrO3+3H2SO4 ==== 3Br2+3Na2SO4+3H2O
18.(8分)(2010·宣城高二检测)A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应。
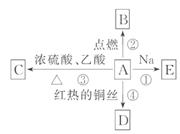
(1)A的名称_______;C的分子式为________。
(2)写出下列反应的化学方程式:
反应③______________________________________;
反应④______________________________________。
(3)比较反应① 与钠和水反应的现象有什么相同和不同:
与钠和水反应的现象有什么相同和不同:
相同点:____________________________________;
不同点:____________________________________。
[解析]本题考查了乙醇的化学性质,解题时要充分利用“结构决定性质”的思想,同时利用Na与乙醇、H2O的反应比较乙醇分子中羟基氢的活泼性,根据A能发生反应①、②、③、④,说明A为醇,又因为A为实验室中最常见的有特殊香味的有机物,所以A为乙醇,则C为乙酸乙 酯,D为CH3CHO,E为CH3CH2ONa,最后依据H2O中的羟基氢比乙醇中的羟基氢活泼即可比较出Na与乙醇、H2O反应现象的异同点。
酯,D为CH3CHO,E为CH3CH2ONa,最后依据H2O中的羟基氢比乙醇中的羟基氢活泼即可比较出Na与乙醇、H2O反应现象的异同点。
答案:(1)乙醇 C4H8O2
(2)CH3COOH+CH3CH2OH
 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
2CH3CH2OH+O2
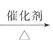 2CH3CHO+2H2O
2CH3CHO+2H2O
(3)都有无色气泡 产生,都有热量放出
产生,都有热量放出
乙醇与钠反应时,钠沉在液面下,反应更平稳
17.(8分)空气质量越来越受到人们的关注,下面是山东部分城市的一次空气质量周报表:
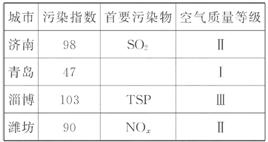
注:TSP--总悬浮颗粒物;NOx--氮氧化物
(1)由上表可知,最容易出现酸雨的城市是_______。
(2)悬浮颗粒物不易沉降,它与空气中的SO2、O2接触时,部分SO2会转化为SO3,悬浮颗粒物所起的作用是_________(填序号);
A.氧化剂  B.还原剂 C.催化剂 D
B.还原剂 C.催化剂 D .吸附剂
.吸附剂
(3)氮氧化物也是大气污染物之一。目前,治理NO的方法是在一定条件下用氨把一氧化氮还原为氮气和水。科学家又设想,在相同条件下可采用价格更便宜的天然气来处理NO,可得到同样效果,写出该反应的化学方程式_____________________________________。
[解析](1)酸雨主要是由于SO2、NO2所致,因此最容易出现酸雨的城市是济南。
(2)悬浮颗粒物与空气中的SO2、O2接触,SO2被氧化成SO3,悬浮颗粒物起催化剂作用。
(3)据信息知CH4与NO作用生成N2、CO2和H2O,因此化学方程式为:4NO+CH4=====2N2+CO2+2H2O。
答案:(1)济南 (2)C
(3)4NO+CH4====2N2+CO2+2H2O
16.(9分)(1)氧化银是黑色固体,其含银量相当高,从废氧化银中冶炼银,可采用的方法是____________,
反应方程式是________________________________。
(2)检验X- 的性质时,常生成AgX沉淀,如果将AgX(AgCl、AgBr、AgI)等丢弃,则十分可惜。试设计实验方案,从AgX中回收白银。
___________________________________________。
(3)常有不法职业人员从实验室中带出AgNO3,到银匠店铺灼烧制取白银。发生反应的化学方程式为________;同时看到有红棕色气体生成,该气体对人体十分有害,其主要成分是____________(写化学式)。
[解析](1)Ag+ 得电子能力很强,加热时即可使Ag2O中的Ag+ 还原为Ag。
(2)AgCl、AgBr、AgI在高温灼烧时均能分解产生Ag。
(3)AgNO3不稳定,受热易分解,反应方程式为2AgNO3  2Ag+2NO2↑+O2↑。NO2是有刺激性气味的有毒气体,对人体有害。
2Ag+2NO2↑+O2↑。NO2是有刺激性气味的有毒气体,对人体有害。

15. 酯类物质广泛存在于香蕉、梨等水果中。某实验小组先从梨中分离出一种酯,然后将分离出的酯水解,得到了乙酸和另一种分子式为C6H14O的物质。对于此过程,以下分析不正确的是( )
酯类物质广泛存在于香蕉、梨等水果中。某实验小组先从梨中分离出一种酯,然后将分离出的酯水解,得到了乙酸和另一种分子式为C6H14O的物质。对于此过程,以下分析不正确的是( )
A.C6H14O的结构中含有羟基
B.这种酯与水混合加热即可彻底水解
C.C6H14O可与金属钠反应
D.这种酯可表示为CH3COOC6H13
[解析]选B。酯水解生成醇和羧酸,在碱性条件下才能彻底水解,因为C6H14O为醇,其官能团为羟基,能与Na反应放出H2,又因为酯+H2O
 CH3COOH+C6H14O,故该酯可表示为CH3COOC6H13。
CH3COOH+C6H14O,故该酯可表示为CH3COOC6H13。
第Ⅱ卷(非选择题 共55分)
14.下列各对物质中必定属于同系物的是( )
A.(C6H10O5)m(淀粉)和(C6H10O5)n(纤维素)
B.分子式为C7H8O和C8H10O的含苯环有机物
C.CH3CH2CH2OH和CH3CH(OH)CH3
D.HCOOH和C17H35COOH
[解析]选D。A中淀粉和纤维素结构不同;B中C7H8O和C8H10O可能是醇,也可能是其他种类物质;C中物质是同分异构体;D项两物质均为饱和一元羧酸。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com