
题目列表(包括答案和解析)
2.如图所示的装置中,能够组成原电池,产生电流的是( )
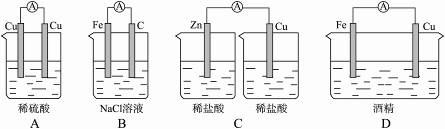
解析:根据构成原电池的条件必须同时满足:(1)要有活动性不同的两个电极。如金属与金属,金属与非金属(如石墨)等。(2)要有电解质溶液,如酸、碱或盐溶液都可以。(3)要有导线,能形成闭合回路。
由此条件进行判断:A项中两个电极的金属性相同,不符合条件(1)。C项中没有构成闭合回路,不符合条件(3)。D项中没有电解质溶液,酒精是非电解质。所以只有B项符合条件。
答案:B
1.自行车、电动自行车、普通汽车消耗能量的类型分别是( )
①生物能 ②核能 ③电能 ④太阳能 ⑤化学能
A.①④⑤ B.①③⑤ C.①②③ D.①③④
解析:人骑自行车是将生物能转化为机械能;电动自行车是将蓄电池的电能转化为机械能;普通汽车是将汽油的化学能转化为机械能,所以B选项正确。
答案:B
4.1 mol氢气燃烧时约放热286 kJ,而每千克汽油燃烧时约放热4 600 kJ。氢气被认为是本世纪替代矿物燃料的理想能源。试述氢气作为能源的三个主要优点:
①______________________;②______________________;③______________________。
可从H2和汽油的燃烧产物的异同点对比得出结论:
产物:H2生成H2O,汽油生成H2O、CO2,还有少量CO、SO2等污染物;
放热:每千克汽油燃烧时约放出4 600 kJ,每千克H2放出286×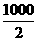 =143
000 kJ,是汽油的3.1倍。
=143
000 kJ,是汽油的3.1倍。
H2可来自水,汽油要由石油分馏或裂化产生。
答案:①来源丰富 ②单位质量的氢气燃烧时放出热量多 ③燃烧后不产生污染物
10分钟训练(强化类训练,可用于课中)
3.市场上出售的“热敷袋”中含有铁屑、炭粉、木屑和少量氯化钠、水等,热敷袋启用前,用塑料袋和空气隔绝,启用时打开塑料袋,轻轻揉搓就会放出热量。试完成下列问题:
(1)热敷袋产生热量的来源是_____________________________________________________。
(2)炭粉的主要作用是___________________________________________________________。
(3)加入NaCl的作用是__________________________________________________________。
(4)木屑的作用是_______________________________________________________________。
解析:本题主要考查学生对原电池原理的掌握和应用的题目,是一道理论联系实际的好题。
答案:(1)铁被氧化放出的热量
(2)与铁屑、NaCl溶液构成原电池,加速铁屑的氧化
(3)NaCl溶于水,形成电解质溶液
(4)使用“热敷袋”时受热均匀
2.X、Y、Z都是金属,把X投入Z的硝酸盐溶液中,X的表面有Z析出,X 与Y组成原电池时,Y为电池的负极,X、Y、Z三种金属的活泼性顺序为( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
解析:X能把Z从其硝酸盐溶液中置换出来,说明X的活泼性强于Z;X 与Y组成原电池时,Y为电池的负极,说明Y的活泼性强于X,故正确答案为C。
答案:C
1.根据Zn+Cu2+====Zn2++Cu的反应原理设计一个原电池,当Zn为负极时,正极可以选用的金属材料是( )
A.镁 B.石墨 C.铝 D.铅
根据原电池形成条件,要使Zn作负极,与它相连的金属必须要比Zn的活泼性差,石墨为非金属,故答案为D。
答案:D
15.A、B、C、D、E五种元素,C和D原子序数分别比E和A的原子序数大1,B和D的离子具有相同的电子层结构,B是同周期中原子半径最大的元素(除稀有气体元素外)。A元素在其最高价氧化物中含量是40%,在其氢化物中的含量是94.1%,A元素原子中质子、中子、电子数相等。18 g C的单质与足量的稀硫酸反应,在标准状况下,生成22.4 L氢气。C元素原子中有14个中子。则:
(1)A、B、C、D、E各是(填写元素符号) _________________________________________。
(2)A、B、C、D、E在周期表中的位置依次是____________________________________。
(3)A、B、C、D、E中得电子能力最强的元素是_________________,失电子能力最强的元素是____________。
(4)现行元素周期表中得电子能力最强的元素是_________________,失电子能力最强的元素是______________。
(5)随着周期表的逐步完善,用发展的观点分析,元素周期表中得失电子能力最强的元素是否会发生变化?
解析:本题是将物质结构、元素及其化合物知识以及元素的结构、位置和性质等知识结合起来对元素种类进行推断。题目中要求推断的五种元素中,对A元素提供的条件很充分,对A进行有关化学式计算是解答本题的一个突破口。另外,C元素也可通过化学方程式计算求得其相对原子质量,进而确定C元素种类。
答案:(1)S、K、Al、Cl、Mg
(2)第三周期ⅥA族、第四周期I A族、第三周期ⅢA族、第三周期ⅦA族、第三周期ⅡA族
(3)Cl K (4)F Fr
(5)随着周期表的逐步完善,将来出现新的周期之后,最左下方的元素会发生变化而最右上方的元素是不会发生变化的,即得电子能力最强的元素不会变,而失电子能力强的元素会发生变化。
14.氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用生成NH3和氢氧化钠。请完成下列问题:
(1)Na3N的电子式是____________,该化合物由____________键形成。
(2)Na3N与盐酸反应生成____________种盐。
(3)Na3N与水反应属于____________反应(填基本反应类型)。
(4)比较Na3N中两种粒子的半径:Na+____________N3-(填“>”“=”或“<”)
解析:钠是活泼金属,氮是较活泼非金属,Na3N属于离子化合物。Na3N与水反应,钠离子结合氢氧根离子,氮离子结合氢离子形成氨,NH3与HCl反应生成铵盐。
答案:(1)Na+[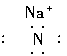 ]3-Na+ 离子
]3-Na+ 离子
(2)2 (3)复分解 (4)<
13.某同学在画某种元素的一种单核粒子的原子结构示意图时,忘记在圆圈内标其质子数.请你根据下面的提示作出自己的判断。
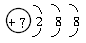
(1)该粒子是中性粒子,这种粒子的符号是__________________。
(2)该粒子的盐溶液能使溴水褪色,并出现浑浊,这种粒子的符号是________________。
(3)该粒子的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,这种粒子的符号是
________________。
(4)该粒子的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,这种粒子的符号是
________________。
解析:题设中“粒子”的核外电子排布为2、8、8,是一种稳定结构,该粒子可以是原子,也可以是阴、阳离子。如果是中性粒子即原子,核内的质子数应该等于核外的电子数,即2+8+8=18,质子数为18的元素是Ar;在溶液中能使溴水褪色并出现浑浊的物质应该是硫化物,该粒子应该是S2-;粒子得到1个电子后变为原子,则其原子的电子数应该为18+1=19,质子数应该是19,即钾原子,则这种粒子是K+,K+的氧化性很弱而钾的还原性很强,符合题目要求;粒子失去1个电子后变为原子,则其原子的电子数应该为18-1=17,质子数应该是17,即氯原子,则这种粒子是Cl-,Cl-的还原性很弱而氯原子的氧化性很强,符合题目要求。
答案:(1)Ar (2)S2- (3)K+ (4)Cl-
12.下图是某同学画的六种粒子的原子结构示意图,请你给他认真批改,指出其中的错误。
a.Li 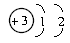 b.K
b.K 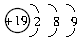 c.Cl
c.Cl 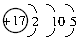 d.Kr
d.Kr 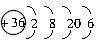 e.S2-
e.S2- 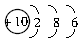 f.Mg2+
f.Mg2+ 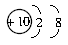
解析:本题实际上可加深我们对核外电子分层排布四条规律的理解。在分析粒子的原子结构示意图正误时,这四条规律必须同时满足。原子结构示意图除可以表示原子的结构外,还可以表示阴、阳离子的结构。需要注意的是,表示阴、阳离子的结构时,核内的质子数与核外电子数是存在差别的。
答案:(1)根据电子总是尽量先排布在能量较低的电子层,应该先排满第一层再排第二层,第一层最多可以容纳2个电子,剩下1个排在第二层,所以a是错误的。
(2)第三层最多可以容纳18个电子,但是在此结构中,第三层同时是最外层,最外层容纳的电子数不能超过8个,所以K原子的核外电子排布随电子层数的递增依次为2、8、8、1,b也是错误的。
(3)第二层最多容纳8个电子,所以c错。
(4)第三层最多容纳18个电子,所以d错。(5)S2-的核外电子数为18,所以S2-的核外电子排布应该为2、8、8,所以e错。
(6)Mg2+的核外电子数为10,但核内的质子数仍然为12而不是10,所以f错。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com