
题目列表(包括答案和解析)
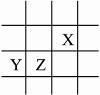
15.X、Y、Z均为短周期元素,它们在周期表中的相对位置如右图所示,已知X、Y、Z三元素的质子数之和为31,试完成下列问题:
(1)X原子的电子式为______________________。
(2)Y的最高价氧化物的电子式______________________。
(3)Z的单质与盐酸反应的化学方程式。
解析:若X质子数为n,则Y、Z质子数分别为n+8-2,n+8-1,得n+n+8-2+n+8-1=31,n=6,X为碳元素,Y为镁元素,Z为铝元素。
答案:(1) 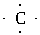
(2) 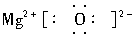 (3)2Al+6HCl====2AlCl3+3H2↑
(3)2Al+6HCl====2AlCl3+3H2↑
14.A、B、C三种元素的原子具有相同的电子层数,且B的核外电子数比A多2个,C的质子数比B多4个,1 mol A的单质与酸反应,能置换出1 g H2,这时,A转化为具有与氖原子相同的电子层结构的离子。请完成下列问题:
(1)写出A、B、C的元素符号。
(2)写出A的单质与水反应的离子方程式。
(3)写出A与C单质化合的化学方程式,指出氧化剂和还原剂。
解析:本题考查学生运用原子(或离子)结构结合化学方程式综合解题的能力。本题可以从判断单质A入手分析,因为1 mol A与酸反应置换出0.5 mol H2,所以1 mol A失去1 mol e-从而形成A+结构。A+与氖原子电子层结构相同,不难得出A是Na。其他原子的名称便迎刃而解。
答案:(1)A:Na B:Al C:Cl
(2)2Na+2H2O====2Na++2OH-+H2↑
(3)2Na+Cl2====2NaCl,其中Na是还原剂,Cl2是氧化剂
13.将洁净的金属片A、B、C、D分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如下:
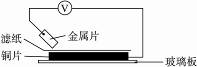
金属 电子流动方向 电压/V
A A→Cu -0.78
B Cu→B -0.15
C C→Cu +1.35
D D→Cu +0.30
已知,构成两电极的金属其金属活泼性相差越大,电压表的读数越大。请依据记录数据判断,下列有关说法正确的是( )
A.在四种金属中C的还原性最强
B.金属B能从硫酸铜溶液中置换出铜
C.A、D若形成原电池时,A为正极
D.A、B形成合金时,将该合金露置在空气中,A先被腐蚀
解析:由题意中的电子流向可知金属性强弱为A>Cu,B<Cu,C>Cu,D>Cu,由此可推断B、C项错误,D项正确。再由电压数据的最大值为+1.35,可知C的金属性最强,所以A项正确。
答案:AD
12.下列事实不能用电化学理论解释的是( )
A.镀锌铁比镀锡铁耐腐蚀
B.轮船水线以下的船壳上,镶嵌一定量的锌块
C.铝片不用特殊的方法保存
D.纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后反应速率加快
解析:由于铝在空气中发生化学腐蚀生成一层氧化物薄膜,起到保护作用,所以与电化学理论无关。
答案:C
11.有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易被腐蚀。将A、D分别投入等浓度盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化。如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是( )
A.D、C、A、B B.D、A、B、C
C.D、B、A、C D.B、A、D、C
解析:A、B形成原电池,B不易被腐蚀,则A为负极,B为正极,活泼性A>B;A、D放入HCl中,D反应剧烈,则活泼性D>A,Cu不能置换B而Cu能置换C,则活泼性B>Cu>C。所以活泼性为:D>A>B>C。
答案:B
10.下图所示能够组成原电池,并且能产生明显的电流的是( )
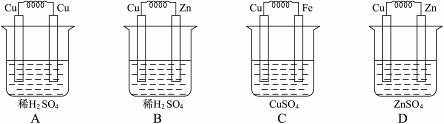
解析:首先按照构成原电池的条件,B、C、D项为原电池,但D项中的Zn与硫酸锌不反应,且溶液酸性弱,产生电流弱。
答案:B、C
9.将铁片和银片用导线连接置于同一稀盐酸溶液中,并经过一段时间后,下列叙述正确的是( )
A.负极有Cl2逸出,正极有H2逸出
B.负极附近Cl-的浓度减小
C.正极附近Cl-的浓度逐渐增大
D.溶液中Cl-的浓度基本不变
解析:Fe为负极:Fe-2e-====Fe2+;Ag为正极:2H++2e-====H2↑;Cl-的浓度基本不变。
答案:D
8.对于原电池的组成条件,某同学列出了以下几点,其中正确的是( )
A.有两种活动性不同的金属(或非金属单质)作电极
B.电极材料均插入电解质溶液中
C.电极必须是金属
D.两极相连形成闭合电路
E.必须有一个自发的氧化还原反应
解析:由形成原电池的条件是可知,组成原电池的条件是A、B、D、E。电极有两个,负极必须是较活泼的金属,而正极可以是较不活泼的金属,也可以是非金属,如碳棒。
答案:ABDE
7.下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片做阳极,铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
解析:铜铁是两种活泼性不同的金属,稀硫酸是电解质溶液,三者共同形成原电池,铁片上发生氧化反应:Fe-2e-====Fe2+;铜片上发生还原反应:2H++2e-====2H 2H====H2↑故A选项正确;B选项中Zn片上发生氧化反应Zn-2e-====Zn2+,铁片上发生还原反应,溶液中的 Zn2++2e-====Zn沉积在铁片上,故B选项正确;C选项发生的反应为:Cu+2FeCl3====2FeCl2+CuCl2,故C错误;在D选项中由于发生Zn+Cu2+====Zn2++Cu,Cu沉积在Zn片上形成原电池,加快了氢气放出的速率,D选项也正确。
答案:C
6.下列有关原电池的叙述正确的是( )
A.把电能转变为化学能,使溶液发生氧化还原反应
B.电子从活泼金属流向不活泼金属,不活泼金属为负极
C.外电路中电子从负极流向正极
D.正极发生氧化反应
解析:原电池是化学能转化为电能的装置,故A项错误。原电池中活泼金属作负极,失电子,电子沿导线流向正极;负极发生氧化反应,正极发生还原反应。故B、D项错误,C项正确。
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com