
题目列表(包括答案和解析)
25.(9分)已知由硝酸银和硝酸铜组成的100mL混合溶液中,c(NO3-)=2mol/L。现往其中加入一定量的铝粉,充分反应后过滤,将滤纸上的沉淀干燥后称重为12.4g。将此沉淀加入稀盐酸中无气体产生。滤液中滴入NaCl溶液无现象。后加入过量的稀NaOH溶液得到沉淀。过滤、加热、冷却、称重为2g。
求:(1)原混合溶液中硝酸银和硝酸铜的物质的量之比。
(2)参加反应的铝的质量。
24.(13分)有资料报道:铁酸钠(Na2FeO4)是一种强氧化剂,可作为一种新型净水剂,在反应中被还原为Fe3+离子,使用该物质可代替Cl2和Al2(SO4)3。
(1)用废铁屑制Fe2O3 。向有铁锈的废铁屑中加入稀硫酸,至铁屑全部溶解。再通过系列化学过程得到Fe2O3 。写出向有铁锈的废铁屑中加入稀硫酸过程中的离子反应方程式。
______________________________________________________________ ______________________________________________。
(2)制备铁酸钠。氧化铁在碱性溶液中与硝酸钠反应制得铁酸钠。
Fe2O3 +NaNO3 +NaOH → Na2FeO4+NaNO2 +H2O (未配平)
当反应物中含有1.4 mol Na+ ,上述反应恰好完全进行时,电子转移总数为_______NA。
(3) 制备铁酸钠后的废液中含NaNO2溶液,直接排放会造成污染,下列试剂中①NaCl ②NH4Cl ③KMnO4 ④浓硫酸,能使NaNO2转化为N2(不引起二次污染的)的是______(选填试剂编号),离子反应方程式____________________________________。
23.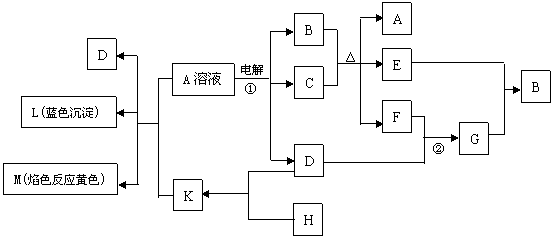 (10分) 下列物质的相互转化关系中,已知B是基础化学工业的重要产品,它的消费量常被视为一个国家工业水平的一种标志,K是含非极性键的离子化合物,E是无色无味的液体。试回答:
(10分) 下列物质的相互转化关系中,已知B是基础化学工业的重要产品,它的消费量常被视为一个国家工业水平的一种标志,K是含非极性键的离子化合物,E是无色无味的液体。试回答:
(1)G的化学式为___________________,K的电子式为_____________________。
(2) 反应①的离子方程式____________________________________________。
(3) 反应②工业上称F为接触氧化反应,根据化学平衡理论和下表F转化率的实验数据,考虑综合经济效益,你认为提高F转化率工业上应采取的反应条件及有效措施是
_______________________________________________________ 。
|
|
0.1
MPa |
0.5
MPa |
1
MPa |
10
MPa |
|
400
℃ |
99.2 |
99.6 |
99.7 |
99.9 |
|
500
℃ |
93.5 |
96.9 |
97.8 |
99.3 |
|
600
℃ |
73.7 |
85.8 |
89.5 |
96.4 |
22.
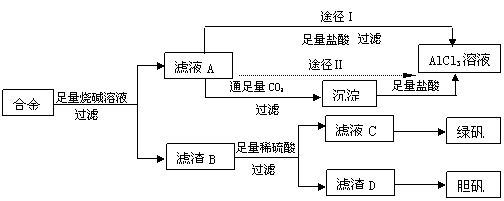 (12分)某化学兴趣小组用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),拟用如下实验方案:
(12分)某化学兴趣小组用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),拟用如下实验方案:
试回答下列问题:
(1)实验中多次进行过滤操作,过滤所用的玻璃仪器有 。
(2)从滤液C中得到绿矾晶体的实验操作是 ___________。
(3)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣D中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,该反应的总化学方程式为 __________________ 。
(4)由滤液A得AlCl3溶液的途径有Ⅰ和Ⅱ,你认为合理的是途径 (填“Ⅰ”或“Ⅱ”),理由是 。
21.(14分) 实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定NaOH的质量分数约为82.0%,为了验证其纯度,用浓度为0.2mol/L的盐酸进行滴定,试回答下列问题:
(1) 称取5.0g该氢氧化钠固体样品,配成500mL溶液备用。
(2)将标准盐酸装在25.00mL酸式滴定管中,调节液面位置在 处,并记下刻度。
(3)取20.00mL待测液,待测定。该项实验操作的主要仪器有 。
用 试剂作指示剂时,滴定到溶液颜色由 刚好至 色时为止。
(4)滴定达终点后,记下盐酸用去20.00mL,计算NaOH的质量分数为 。
(5)试分析滴定误差可能由下列哪些实验操作引起的 。(选填编号)
A.(1)中,转移待测液至容量瓶时,未洗涤烧杯
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸
C.滴定时,反应容器摇动太激烈,有少量液体溅出
D.滴定到终点时,滴定管尖嘴悬有液滴
E.读滴定管开始时仰视,读终点时俯视
20.假设SiO2 原子晶体中Si原子被Al原子取代,不足的价数由K原子补充。当有25%的硅原子被铝原子取代时,可形成正长石,则正长石的化学组成为
A.KAlSiO4 B.KAlSi2O6
C.KAlSi3O8 D.KAlSi4O10
|
高二周练化学试题
三 非选择题
19.已知某溶液中存在OH―、H+、NH4+和 Cl― 四种离子,其浓度大小有如下关系:
①c(Cl―)> c(NH4+)> c(H+)> c(OH―)
②c(NH4+)= c(H+)>c(Cl―) > c(OH―)
③c(Cl―)= c(NH4+)且c(OH―)= c(H+)
④c(OH―)> c (H+)> c(Cl―)> c(NH4+)
⑤c(Cl―)> c(H+)> c(NH4+)> c(OH―)
其中可能正确的是
A.①④ B.②⑤
C.③④ D.①③⑤
18.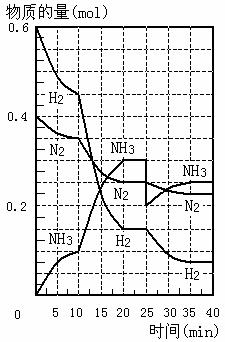 500℃、20Mpa时,将H2和N2置于一容积为
500℃、20Mpa时,将H2和N2置于一容积为
2L的密闭容器中发生反应。反应过程中H2、N2
和NH3物质的量变化如图所示,下列说法正确
的是
A.反应开始到第一次平衡时,N2的平均反应速
率为0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到10min至
20min钟时可能是使用了催化剂
C.从曲线变化可以看出,反应进行至25min钟
时,分离出0.1mol的氨气
D.在25min钟时平衡正向移动但达到新平衡后
NH3的体积分数比原平衡小
17.下列各选项所述的两个量,前者一定大于后者的是
①HF和HBr的沸点,②纯水在25℃和80℃时的pH,③同温下分别在100g水中最多能溶解的无水CuSO4和CuSO4·5H2O的质量,④25℃时,等体积的pH都等于3的盐酸和AlCl3溶液中,已电离的水分子数,⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数,⑥耐火材料MgO和CaO的熔点,⑦H-和H+离子半径,⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数
A.①②⑥ B.①②③⑤ C.⑤⑥⑦ D.①②⑥⑦
0.5molN2、1.5molH2,反应一段时间后,A、B中均达到平衡状态。下列判断正确的是
A.A中吸热92.4kJ B.B中放热46.2kJ
C.A中热量变化值大于B中的2倍 D. A中热量变化值等于B中的2倍
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com