
题目列表(包括答案和解析)
3.Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大进展,因此这三位教授荣获了1998年诺贝尔医学及生理学奖,关于NO的下列叙述不正确的是 A.NO是红棕色气体 B.NO可以是某些含高价N物质还原的产物 C.NO不是亚硝酸酐 D.NO可以是某些含低价N物质氧化的产物
2.下列气体不会造成大气污染的是 A.二氧化硫 B.氮气 C.一氧化碳 D.一氧化氮
1.在下列过程中,需要加快化学反应速率的是
A.钢铁腐蚀 B.食物腐败 C.炼钢 D.塑料老化
35.为了预防碘缺乏病,国家规定每千克食盐中应含有40-50毫克的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428克,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的硫代硫酸钠溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下:IO3-+5I-+6 H+→3I2+3H2O I2+2S2O32-→2I-+S4O62-
34.(3分)在10ml Al2(SO4)3溶液中逐滴加入4mol/L NaOH溶液,当滴至20ml溶液由浑浊恰好变为澄清,则Al2(SO4)3溶液的物质的量浓度为 ___ mol/L。
32(2分).下列操作会引起实验误差的是 (填序号)
A.进行中和滴定时,直接向刚洗净的锥形瓶中加待测液 B.滴定未知浓度盐酸所用的0.05mol/L NaOH溶液, 在配制标准液称量NaOH固体时因与
空气接触吸收了少量的水蒸气和CO2 C.用标准NaOH溶液滴定未知浓度的稀H2SO4时,用酚酞作指示剂 D.往洗净的滴定管中,直接加入标准液.
33.(8分)某学生为测定氯化铵和硫酸铵混合物中氯化铵的含量,按下图所示实验步骤进行实验
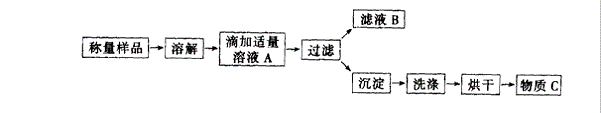
简答下列问题:
(1)溶液A中溶质的化学式______________,物质C的化学式是_______________。
(2)用托盘天平称量样品,当天平平衡时,发现左盘错放砝码16g,游码为0.4g,则右盘样品实际质量是__________g。
(3)若过滤使用的仪器和用品已有:滤纸、铁架台、铁圈、烧杯、漏斗,还需要补充的仪器或用品是_______________。
(4)证明A溶液滴加适量的操作方法是_________________________________________ _
________________________________________________。
(5)若物质C的质量为23.3g,则原混合物中NH4Cl的质量分数为________________________。
29(2分).下列各物质的溶液物质的量浓度均为0.1mol/L. ①HCl ②NaOH ③Na2CO3 ④CH3COONa
⑤NH4Cl ⑥Ba(OH)2 ⑦KCl ⑧CH3COOH 按它们pH由小到大的排列顺序为 (填代号).
30(7分).现有A、B、C、D四瓶无色溶液,它们分别是磷酸钠、硝酸、碳酸钠和氯化钙。将其两两混合,现象如下:
(1)将A和B混合,B和C混合,都有沉淀产生。
(2)将A和D混合有气体产生。
试推断:A是________;B是________;C是________;D是________。
有关离子方程式为:
(1)________________________________________
(2)________________________________________
(3)________________________________________
31(5分).将含有Ag+、Mg2+、Al3+、Na+等离子的稀溶液,按下列实验步骤进行分离。填写下列空白(各步可使用的试剂限于在NaOH、HCl、NaCl中选择)

① 适量
过滤 过滤 ③
②
(1)沉淀A是 ,沉淀C ,沉淀E是
(2)加入试剂①是 ,③是_________。
26(3分).完成并配平下列化学方程式:
□Na2Cr2O7+□KI+□HCl→□CrCl3+□NaCl+□KCl+□I2+□
该反应的电子转移数为 。
27(4分).写出Mg(HCO3)2,Ca(HCO3)2分别与过量的NaOH反应的离子方程式:
(1)
(2)
28(8分)pH=13的强碱溶液与pH=2的强酸溶液混合,若所得混合液的pH=7,则强 碱与强酸的体积比是:______________;若所得混合液的PH=11,则强碱与强酸的体积比是:___________. PH=2的盐酸与 PH=5的盐酸等体积混合后所得溶液的PH为________,PH=8的氢氧化钾溶液与 PH=11的氢氧化钾溶液等体积混合后所得溶液的PH为_________.
25.有人曾建议用AG表示溶液的酸度,AG的定义为AG=lg[c(H+)/c(OH-)]。下列表述正确的是
A.在25℃时,若溶液呈中性,则pH=7,AG=1
B.在25℃时,若溶液呈酸性,则pH<7,AG<0
C.在25℃时,岩溶液呈碱性,则pH>7,AG>0
D.在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH)
▲请将选择题答案填入下表!
|
题序 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
答案 |
|
|
|
|
|
|
|
|
|
|
|
|
|
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
第II卷(非选择题 共50分)
24.下列各组离子,在溶液中不能大量共存的是
A.NO3- Fe2+ Cl- H+ B.Na+ OH- NH4+ AlO2-
C. Al3+ NO3- S2- OH- D.K+ OH- Na+ S2-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com