
题目列表(包括答案和解析)
9.以水为溶剂进行中和滴定的原理是:H3O++OH-=2H2O。已知液态SO2和纯水的导电性相近,因为液态SO2也会发生自离解:SO2(l)+SO2(l)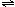 SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是[ ]
SO32-+SO2+。若以液态SO2为溶剂,用SOCl2滴定Cs2SO3,则以下叙述错误的是[ ]
A.该滴定反应可以表示为:SO32- + SO2+=2SO2
B.在一定温度下,液态SO2中c(SO32-)与c(SO2+)的乘积是一个常数
C.自离解的存在,说明SO2是离子化合物
D.可通过导电能力变化来判断是否到达滴定终点
8.下列电离方程式中正确的是
A.Na2HPO4溶于水:Na2HPO4=2Na++H++PO43-
B.NaHSO4熔化:NaHSO4=Na++H++SO42-
C.HF溶于少量水:2HF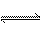 H++HF2一
H++HF2一
D.(NH4)2 SO4溶于水:(NH4)2 SO4=2NH4++SO42一
7.某无色溶液能与铝反应放出氢气,该溶液中肯定不能大量共存的离子组是:
A.Cl-、Mg2+、SO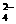 、K+ B.NH
、K+ B.NH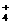 、Cl-、Na+、Ba2+
、Cl-、Na+、Ba2+
C.SO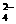 、Cl-、CO
、Cl-、CO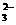 、Na+ D.HCO
、Na+ D.HCO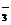 、K+、NO
、K+、NO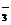 、SO
、SO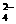
6.pH=9的Ba(OH)2溶液与pH=12的KOH溶液,按4︰1的体积比混合,则混合溶液中H+浓度为(单位:mol·L-1)
A.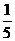 ×(4×10-9+1×10-12)
B.
×(4×10-9+1×10-12)
B.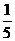 ×(8×10-9+1×10-12)
×(8×10-9+1×10-12)
C.5×10-10 D.5×10-12
5.本题所列的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
4.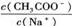 欲使CH3COONa稀溶液中的值增大,可采取的措施是
[ ]
欲使CH3COONa稀溶液中的值增大,可采取的措施是
[ ]
A.升温 B.加水稀释 C.加少量的KOH固体 D.加少量固体Na2CO3
3.下列有关分步沉淀的叙述,不正确的是
A.溶解度小的物质先沉淀 B.浓度积先达到Ksp的先沉淀
C.组成类型相同时,溶度积小的物质先沉淀 D.被沉淀离子浓度大的先沉淀
2.下列说法不正确的是
A.增大反应物浓度,可增大单位体积内活化分子的数目,从而使反应速率增大
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了反应物中活化分子的百分数
D.催化剂能增大单位体积内活化分子的百分数,从而增大反应速率
1.下列说法中正确的是
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减小或不变
C.熵增加且放热的反应一定是自发反应
D.非自发反应在任何条件下都不能实现
26.2.4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com