
题目列表(包括答案和解析)
13.将质量分数为0.052 (5.2%) 的NaOH溶液1 L ( 密度为1.06 g·cm-3 ) 用铂电
极电解,当溶液中NaOH的质量分数改变了0.010 (1.0%) 时停止电解,则此时溶
液中应符合的关系是
|
|
NaOH的质量分数 |
阳极析出物的质量/g |
阴极析出物的质量/g |
|
A |
0.062 (6.2%) |
19 |
152 |
|
B |
0.062 (6.2%) |
152 |
19 |
|
C |
0.042 (4.2%) |
1.2 |
9.4 |
|
D |
0.042 (4.2%) |
9.4 |
1.2 |
12.下列描述中,不符合生产实际的是
A.电解熔融的氯化钠可制取金属钠,电解熔融的氧化铝可制取金属铝
B.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
C.在镀件上电镀锌,用锌作阳极,镀件作阴极
D.电解法精炼粗铜,用纯铜作阳极,粗铜阴极,CuSO4溶液为电解液
10.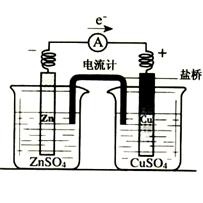 有关如右图所示原电池(盐桥中装有含琼胶
有关如右图所示原电池(盐桥中装有含琼胶
的KCl饱和溶液)的叙述,正确的是
A.铜片上有气泡逸出
B.取出盐桥后,电流计依然发生偏转
C.反应中,盐桥中的K+会移向CuSO4溶液
D.铜片上发生氧化反应
11将两个铂电极插人KOH溶液中,向两极分别通人CH4和O2,构成甲烷燃料电池。已知。通入CH4的一极,其电极反应式是:CH4 + 10OH- - 8e-=CO32-+7 H2O;另一极通入O2。下列叙述不正确的是。
A.通人CH4的电极为负极
B.正极发生氧化反应
C.燃料电池工作时,溶液中的OH-向负极移动
D.该电池使用一段时间后应补充KOH
9.某原电池的电极反应式为:Fe – 2e-== Fe2+,该原电池材料及电解质溶液可能是
|
|
A |
B |
C |
D |
|
正极 |
Fe |
Fe |
C |
Cu |
|
负极 |
Cu |
Zn |
Fe |
Zn |
|
电解质溶液 |
HCl |
CuSO4 |
CuSO4 |
FeSO4 |
8.北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯
(C3H6)。丙烷脱氢可得丙烯。
已知:C3H8(g)  CH4(g)+ C2H2(g) + H2(g) △H1=+156.6 kJ·mol-1
CH4(g)+ C2H2(g) + H2(g) △H1=+156.6 kJ·mol-1
C3H6 (g)

 CH4(g)+ C2H2(g)
△H2=+32.4 kJ·mol-1
CH4(g)+ C2H2(g)
△H2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g)

 C3H6
(g)+ H2(g)
的△H 正确是
C3H6
(g)+ H2(g)
的△H 正确是
A.△H= 一124.2kJ·mol-1 B.△H=+124.2kJ·mol-1
C.△H= +248.4kJ·mol-1 D.不能确定
7.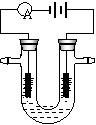 如图所示,在U型管(惰性电极)装入含有紫色石蕊的
如图所示,在U型管(惰性电极)装入含有紫色石蕊的
Na2SO4溶液,通直流电,一段时间后U型内会形成一个倒
立的三色“彩虹”,从左到右颜色的次序是
A.紫、红、蓝 B.红、蓝、紫
C.红、紫、蓝 D.蓝、紫、红
6.在密闭容器里,A与B反应生成C,其反应速率分别用VA、 VB、 VC、表示,已知2 VB =3VA 3 VC =2 VB,则此反应方程式可表示为
A.3A+2B = 3C B.A+3B=2C C.3A+B = 2C D.2A+3B = 2C
5.铜板上铁铆钉处的吸氧腐蚀原理如右图所示,下列有关说法中,不正确的是
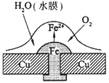 A.正极电极反应式为:2H++2e-→H2↑
A.正极电极反应式为:2H++2e-→H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中铜并不被腐蚀
D.此过程中电子从Fe移向Cu
4.已知H2(g) + Cl2(g) = 2HCl(g) △H= −184.6kJ·mol-1,
则反应HCl(g) = H2(g) + Cl2(g) 的△H为
A.+184.6kJ·mol-1 B.―92.3kJ·mol-1
C.―369.2kJ·mol-1 D. +92.3kJ·mol-1
3.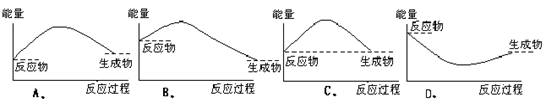 下列各图中,表示正反应是吸热反应的是
下列各图中,表示正反应是吸热反应的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com