
题目列表(包括答案和解析)
20. (11分)如图所示,将4mol X和 2 mol Y混合置于体积可变的等压容器中,在一定温度下发生反应2X(g)+Y(g)
(11分)如图所示,将4mol X和 2 mol Y混合置于体积可变的等压容器中,在一定温度下发生反应2X(g)+Y(g) 2Z(g), (放热反应),该反应达到平衡状态A时,测得气体总的物质的量为4.2 mol,若X、 Y 、Z的起始物质的量分别用a、b、c表示,试回答:
2Z(g), (放热反应),该反应达到平衡状态A时,测得气体总的物质的量为4.2 mol,若X、 Y 、Z的起始物质的量分别用a、b、c表示,试回答:
(1)达到平衡状态A的容器中通入少量Y,体系中X的体积分数将 ,若要使X的体积分数再变至与原平衡状态A相同,可采用的措施有 或 ;
(2)若起始时a = 1.2mol且达到平衡后各气体的体积分数与平衡状态A相同,则起始时b、c的取值分别为 ;
(3)若原平衡状态A是在恒温恒容下达到的,现要使反应开始时向逆方向进行,且达到的平衡状态与A相同,则起始时c的取值范围为 。
19.(6分)下图是目前世界上比较先进的电解法制烧碱技术-阳离子交换膜法的示意图。
(1)为有效除去粗盐中的Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 (填字母);
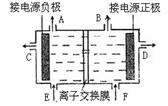 a.先加NaOH,再加Na2CO3,最后加钡试剂;
a.先加NaOH,再加Na2CO3,最后加钡试剂;
b.先加NaOH,再加钡试剂,最后加Na2CO3;
c.先加钡试剂,再加Na2CO3,最后加NaOH。
(2)现有1000mL食盐水,用石墨电极电解。当阴极产生气体的体积为112mL(标准状况)时停止电解,阳极的电极反应式为__________________ _,电解后,溶液在常温下的c(OH-)约为__ _ 。
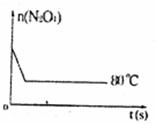
18.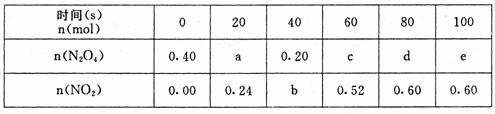 (11分)在80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4
(11分)在80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4
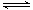 2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)计算20s一40s内用N2O4表示的平均反应速率为 mol· L-1·S-1;
(2)计算在80℃时该反应的平衡常数K= (请注明单位);
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”) ;
 (4)要增大该反应的K值,可采取的措施有(填序号)
;
(4)要增大该反应的K值,可采取的措施有(填序号)
;
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在
60℃时N2O4物质的量的变化曲线。
17.(6分)已知下列两个热化学方程式:
H2(g)+1/2O2(g)=H2O(l)△H=-128.5kJ·mol-1
C3H8(g)+5O2(g)= 3CO2(g)+4H2O(l)△H=-2220.0kJ·mol-1
(1)实验测得H2和C3 H8的混合气体共5 mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3 H8的体积比是_______ ;
(2)已知:H2O(l)==H2O(g) △H=+44.0kJ·mol-1,写出丙烷燃烧生成CO2和气态水的热化学方程式_________________________________________ 。
16.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu2 (OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中共转移的电子数为
A.0.4mol B.0.5mol C.0.6mol D.0.8mol
2008-2009学年度霞浦宏翔高中第二学期高二第一次段考
化学试题
第Ⅱ卷(非选择题,共52分)
15.对于可逆反应2AB3(g)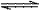 2A(g) + 3B2(g)
ΔH>0 下列图象不正确的是
2A(g) + 3B2(g)
ΔH>0 下列图象不正确的是
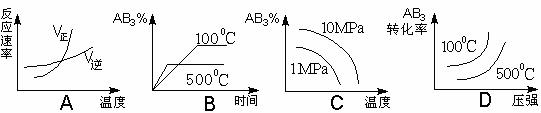
14. 根据下列有关图象,判断下列说法不正确的是
根据下列有关图象,判断下列说法不正确的是
|
|
A.由图象Ⅰ可知,该反应在T2处达到平衡,且该反应的△H<0
B.由图象Ⅱ可知,该反应在t5阶段NH3体积分数最大
C.图象Ⅲ是在10L容器中850℃时反应,由图可知到4min时,反应放出51.6kJ的热量
D.由图象Ⅳ可知,相同条件下起始时投入0.3mol/LX、0.1mol/LY和0.4mol/LZ反应,达到平衡后,Z的浓度为0.4mol/L
13.下列说法或表示法正确的是
A.测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸起始温度、NaOH起始温度和反应后的终止温度
B.已知C(石墨,s)= C(金刚石,s) △H>0,则金刚石比石墨稳定
C.在稀溶液中: H++OH-=H2O △H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH
的溶液混合,放出的热量等于57.3kJ
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:
2H2(g)+O2(g)=2H2O(l) △H= +285.8kJ/mol
12. 镁及其化合物一般无毒(或低毒)、无污染,镁电池放电时电压高且平稳,因而越来越成为人们研制绿色电池所关注的重点。有一种镁二次电池的反应为:xMg+Mo3S4 MgxMo3S4
。下列说法中错误的是
镁及其化合物一般无毒(或低毒)、无污染,镁电池放电时电压高且平稳,因而越来越成为人们研制绿色电池所关注的重点。有一种镁二次电池的反应为:xMg+Mo3S4 MgxMo3S4
。下列说法中错误的是
A.放电时Mg2+ 向正极迁移
B.放电时正极的电极反应为x Mg2+ +Mo3S4 + 2xe- →MgxMo3S4
C.放电时 Mo3S4 发生氧化反应
D.充电时阴极的电极反应为 x Mg2+ + 2xe- →xMg
11.如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述不正确的是
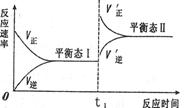 A.反应达平衡时,正反应速率和逆反应速率相等
A.反应达平衡时,正反应速率和逆反应速率相等
B.若反应为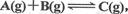 则tl时刻平衡移动的原因可能是增大压强
则tl时刻平衡移动的原因可能是增大压强
C.由图像关系可以判断,正反应为放热反应
D.平衡状态I和平衡状态Ⅱ的平衡常数的大小关系为KI=KII
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com